
| A.离子化合物一定为离子晶体 |
| B.同周期主族元素的原子半径或离子半径都是从左至右减小 |
| C.氢氧化铁胶体带正电荷,加入电解质会产生红褐色沉淀 |
| D.两个非金属元素的原子之间形成的化学键只能是共价健 |
科目:高中化学 来源:不详 题型:单选题
| A.熔点是97.80℃,质软、导电,密度是0.97g/cm3 |
| B.常温常压下是液体,溶于水后能导电 |
| C.熔点极高,硬度极大,液态、固态时,均不能导电 |
| D.固态不能导电,熔点较高,但在熔融状态可以导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子晶体中分子间作用力越大,分子越稳定 |
| B.原子晶体中共价键越强,熔点越高 |
| C.金属晶体发生形变时,金属键发生断裂 |
| D.氯化钠熔化时离子键未被破坏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 :
: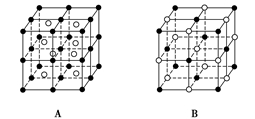
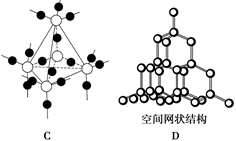
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质中只要有阴离子存在就一定存在阳离子,有阳离子存在也一定有阴离子 |
| B.只由非金属元素组成的化合物不可能含有非极性共价键 |
| C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.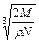 cm cm | B.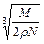 cm cm |
C.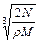 cm cm | D.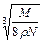 cm cm |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.干冰升华时分子内共价键会发生断裂 |
| B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
| C.分子晶体的熔沸点低,常温下均呈液态或气态 |
| D.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com