
��һ�������£�NO��NO2��Ͽ�����N2O3����Ӧ�Ļ�ѧ����ʽΪ��NO(g)+NO2(g) N2O3(g)
��H<0
N2O3(g)
��H<0
��ͼ��ʾһ������NO��NO2������巢����Ӧʱ��NO2Ũ����ǰ25s�ڵı仯���÷�Ӧ���е�45sʱ�ﵽƽ�⣬���NO2Ũ��ԼΪ0.010mol/L��
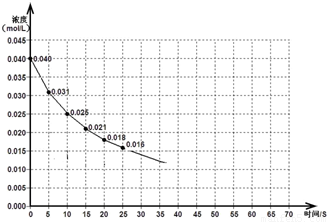
��1��ǰ20s�ڣ�NO2��ƽ����Ӧ����Ϊ_________________��
��2�������������䣬�������¶ȣ�NO2��ת����_______ �����������С�����䡱����
��ѹ������������÷�Ӧƽ����_______�ƶ��������������
��3������Ӧ������70�룬���ڴ��ͼ�л���25����70��ķ�Ӧ�������ߡ�
��4�����ڷ�Ӧ��ʼʱ�������(��������������)�����ڴ��ͼ�л����Ӵ�����ķ�Ӧ�������ߡ�
��5��NO��NO2�Ļ��������NaOH��Һ���գ��õ�����ֻ��һ�֣���÷�Ӧ�����ӷ���ʽΪ��___________________________________���÷�Ӧ����������______________��
��16�֣�
��1��1.1��10��3 mol��L��1��s��1��3�֣���λ����Ч���ִ�©�Ͽ�1�֣�
��2���ټ�С��2�֣� ������2�֣�
��3������4������ͼ����2�֣���4�֣�ע��������㡢б�ʡ�ƽ���Ҫ���д���ÿ��Ҫ�ؿ�1��ֱ��0�֣�ʹ�ô�������ע��1�֣�

��5��NO + NO2 + 2OH��=2NO2��+ H2O��3�֣��� NO2��2�֣�
��������
�����������1����ʼʱ��20sʱ��������Ũ�ȷֱ�Ϊ0.040 mol��L��1��0.018 mol��L��1����ǰ20s�ڶ���������ƽ����Ӧ����= =
= =1.1��10��3mol/(L•s)����2���٦�H<0��˵������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ȷ�Ӧ���淴Ӧ�����ƶ��������������ƽ��ת���ʼ�С����NO(g)+NO2(g)
=1.1��10��3mol/(L•s)����2���٦�H<0��˵������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ȷ�Ӧ���淴Ӧ�����ƶ��������������ƽ��ת���ʼ�С����NO(g)+NO2(g) N2O3(g)������Ӧ�����������С�ķ�Ӧ��ѹ�������������������ѹǿ��ʹƽ�������������С���������Ӧ�����ƶ�����3�������⣬�÷�Ӧ�ﵽƽ���ʱ����45s����25s��45s������������Ũ����0.018mol/L��С��0.010mol/L��45s��70s����������Ũ�ȱ��ֲ��䣻��4����ͼҪ�㣺�ٴ����ܼӿ췴Ӧ���ʣ����̴ﵽƽ���ʱ�䣬��˴ﵽƽ���ʱ��С��45s���ڴ�����ƽ���ƶ���Ӱ�죬�����������ʹƽ���ƶ�����ƽ��ʱ��ƽ������������Ũ��Ϊ0.010mol/L����5�������⣬�����ʵ�����NO��NO2��Ӧ����N2O3��N2O3����ˮʱ�õ������ᣬHNO2��NaOH�����кͷ�Ӧ�������������ƺ�ˮ���ɴ��ƶϻ��������������������Һ��ԭ��Ϊ��NO + NO2 + 2OH��=2NO2��+
H2O���÷�Ӧ��NO�ǻ�ԭ����������Ԫ����+2��Ϊ+3�ۣ���NO2����������������Ԫ����+4��Ϊ+2�ۡ�
N2O3(g)������Ӧ�����������С�ķ�Ӧ��ѹ�������������������ѹǿ��ʹƽ�������������С���������Ӧ�����ƶ�����3�������⣬�÷�Ӧ�ﵽƽ���ʱ����45s����25s��45s������������Ũ����0.018mol/L��С��0.010mol/L��45s��70s����������Ũ�ȱ��ֲ��䣻��4����ͼҪ�㣺�ٴ����ܼӿ췴Ӧ���ʣ����̴ﵽƽ���ʱ�䣬��˴ﵽƽ���ʱ��С��45s���ڴ�����ƽ���ƶ���Ӱ�죬�����������ʹƽ���ƶ�����ƽ��ʱ��ƽ������������Ũ��Ϊ0.010mol/L����5�������⣬�����ʵ�����NO��NO2��Ӧ����N2O3��N2O3����ˮʱ�õ������ᣬHNO2��NaOH�����кͷ�Ӧ�������������ƺ�ˮ���ɴ��ƶϻ��������������������Һ��ԭ��Ϊ��NO + NO2 + 2OH��=2NO2��+
H2O���÷�Ӧ��NO�ǻ�ԭ����������Ԫ����+2��Ϊ+3�ۣ���NO2����������������Ԫ����+4��Ϊ+2�ۡ�
���㣺���黯ѧ��Ӧԭ�����漰��Ӧ���Ũ�ȡ�ʱ��ͼ��ƽ����Ӧ���ʵļ��㡢���������ƽ���ƶ���Ӱ�졢����Ӧ��Ũ����ʱ��仯ʾ��ͼ�������Է�Ӧ���ʺ�ƽ���ƶ���Ӱ�졢���ӷ���ʽ��������ԭ��Ӧ�е��������ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��д����Ӧ�Ļ�ѧ����ʽ������������ת�Ƶķ������Ŀ��
��2�������Ϸ�Ӧ��֣��Լ���ԭ�������NO��NH3�����ʵ������ܸ��Ƕ��١�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�������
PM2.5������ο������Ⱦ������ȼú������أ�ȼú��ͬʱ�ŷŴ�����CO2��SO2��NOx
��1������п�ѧ��������룺�ѿ������뱥��̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״���
����֪�ڳ��³�ѹ�£�
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = ��1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = ��566.0 kJ/mol
H2O(g)=H2O(1) ∆H = ��44.0 kJ/mol
��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ_____________________��
���Լ״���������Ӧ�Ƴɵ�ȼ�ϵ����ͼ��ʾ���õ�ع���������O2Ӧ��______���c����b������ͨ�룬��ظ�����ӦʽΪ__________________��
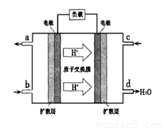
��25��ʱ�����״�ȼ�����ɵ�����CO2ͨ�뵽Ũ��Ϊ0.lmol��L-1��NaOH��Һ�У�������Һ��pH��8����Һ������Ũ���ɴ�С��˳����_________________��
��2����֪��һ�������£�NO��NO2�������з�Ӧ��NO��g��+NO2��g����N2O3��g������H��0���÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��˵��tlʱ�̴ﵽƽ��״̬����____________��

��3����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20molSO2��0.l0molO2������Ӻ�ﵽƽ�⣬��������к�SO30.18mol����v��O2��=__________��������ͨ��0.20mo1SO2��0.lmolO2����ƽ��____________�ƶ����������Ӧ���������淴Ӧ����������
��4����һ�������£�NO2���Ա�NH3��ԭΪN2������NO2�Ի�����ɵ���Ⱦ��25��ʱ����NH3����ˮ��l00mL 0.lmol��L���İ�ˮ�����pH=11�����������NH3��H2O�ĵ���ƽ�ⳣ��ԼΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com