
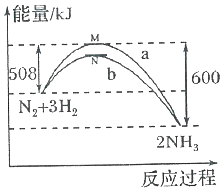
 在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )
在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )| A. | 状态M和N均表示2molN(g)+6mol H(g) | |
| B. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-l | |
| C. | 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量 | |
| D. | 使用催化剂,并不能改变反应的△H |
分析 A、状态M表示2molN(g)+6mol H(g);
B、依据热化学方程式的书写原则,标注物质的聚集状态和反应的热效应,结合断键吸收热量,形成化学键放出热量计算反应的焓变,△H=放出的能量-吸收的能量分析;
C、从催化剂的效果分析,催化剂只能改变化学反应速率;
D、从催化剂的效果分析,催化剂只能改变化学反应速率;
解答 解:A、状态M表示2molN(g)+6mol H(g),故A错误;
B、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g) △H=-92kJ•mol-1,BA错误;
C、催化剂降低活化能,不改变反应热数值,即不能增大反应放出的能量,故C错误;
D、催化剂降低活化能,不改变反应热数值,故并不能改变反应的△H,故D正确,
故选D.
点评 本题考查化学能与热能的相互转化,加入催化剂能降低活化能,并不改变反应热.本题难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的汽化热为40.69 kJ•mol-1,则H2O(g)?H2O(l)△H=40.69 kJ•mol-1 | |||||||||||
| B. | 已知:
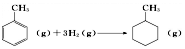 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| C. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||||
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol白磷中含共价键数均为4NA | |
| B. | 1 mol-CH3中含有的电子数为9 NA | |
| C. | 1 mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24 L SO3所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.
TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学应用 | 判断及解释 |
| A | 燃烧法可以鉴别羊毛和棉线 | 对.羊毛的主要成分是蛋白质,燃烧有烧焦羽毛气味. |
| B | 高锰酸钾可用于水果保鲜 | 错.因为高锰酸钾会氧化水果中的有机物 |
| C | SiO2可用于制备光导纤维 | 对.因为SiO2有导电性 |
| D | 误食重金属盐引起人体中毒均可以喝大量食盐水解毒 | 对.因为食盐水有解毒功能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
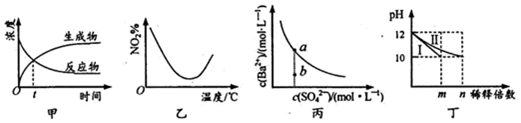
| A. | 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态 | |
| B. | 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)?N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O | |
| C. | 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点 | |
| D. | 图丁表示分别稀释l0mLpH均为12的NaOH和NH3•H2O溶液时pH的变化,曲线I表示NH3•H2O溶液,n>100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明某红棕色气体是溴蒸气还是NO2,可用AgNO3溶液检验,观察是否有沉淀生成 | |
| B. | 将点燃的镁条迅速投入到集满CO2的集气瓶中,观察到镁条在集气瓶底部继续燃烧 | |
| C. | 实验室用氢氧化钠标准溶液滴定未知浓度的醋酸溶液时,选用甲基橙做指示剂 | |
| D. | 向盛有5mL苯酚溶液的试管中滴入2~3滴稀溴水,边加边振荡,立即观察到有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 停止北方冬季供暖,减少有害物质排放 | |
| B. | 寻找新能源,减少化石燃料的使用 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 对锅炉和汽车等产生的有害气体和烟尘等进行处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com