
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(1)FeCl3蚀刻铜箔反应的离子方程式为_____________________________________
________________________________________________________________________。
(2)过程Ⅰ加入铁屑的主要作用是__________________________________________,
分离得到的固体主要成分是____ __________________________________________,
__________________________________________,
从固体中分离出铜需采用的方法是________________________________________。
(3)过程Ⅱ中发生反应的化学方程式为______________________________________
________________________________________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
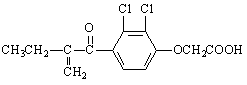
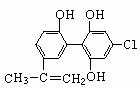
①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是( )
A.利尿酸乙酯分子中有三种含氧官能团,在核磁共振氢谱上共有七个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂最多都能和含3molNaOH的溶液反应
D.两种分子中的所有碳原子均不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)  Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:

① 实验Ⅰ中,前5min的反应速率v(CO2)= 。
②下列能判断实验Ⅱ已经达到平衡状态的是 。
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO) =v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示, b点v正 v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。

(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
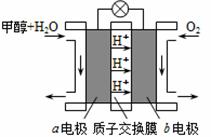
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- ( )
(2013·海南,10C)
(2)将水蒸气通过灼热的铁粉,铁与水在高温下反应,粉末变红 ( )
(2013·广东理综,23D)
(3)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+ ( )
(2013·江苏,13D)
(4)Fe3+有氧化性,所以FeCl3溶液可用于回收废旧电路板中的铜 ( )
(2012·广东理综,12D)
(5)在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热 ( )
(2012·浙江理综,8C)
(6)过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈血红色,说明稀HNO3将Fe氧化为Fe3+ ( )
(2011·安徽理综,10A)
(7)Fe在足量Cl2中燃烧生成FeCl2和FeCl3 ( )
(2012·天津理综,2D)
(8)Fe分别与氯气和稀盐酸反应所得氯化物相同 ( )
(2011·重庆理综,7A)
(9)Fe与S混合加热生成FeS2 ( )
(2012·重庆理综,7A)
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有下列离子组的溶液中,加入Fe(NO3)2固体后,仍然能够大量共存的离子组是( )
A.K+、SO 、NH
、NH 、CO
、CO B.K+、Ba2+、OH-、Cl-
B.K+、Ba2+、OH-、Cl-
C.Na+、H+、Cl-、S O
O D.Na+、Mg2+、Cl-、
D.Na+、Mg2+、Cl-、 NO
NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是:
A.生成物能量一定低于反应物总能量
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.根据盖斯定律,可计算某些难以直接测定的化学反应的反应焓变
D.同温同压下,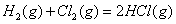 在光照和点燃条件的
在光照和点燃条件的 不同
不同
查看答案和解析>>
科目:高中化学 来源: 题型:
1909年[b20] 化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:
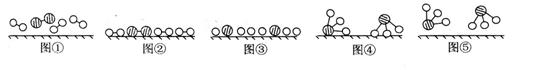
(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是____▲__,__▲ ____。
(2)已知:4NH3(g) + 3O2(g) = 2N??2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) = 2NO(g) ; ΔH = + 180.5kJ/mol, 氨催化氧化的热化学方程式为___▲ _______。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
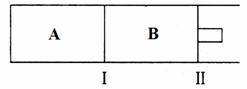
①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为_____▲ _______;保持温度和压强不变,向此容器中通入0.36molN2,平衡将____▲ ______(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为__▲ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com