
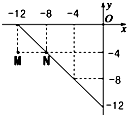
 某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
A、H2O(g)═H2(g)+1
| ||
B、H2O(g)═H2(g)+
| ||
| C、2 H2(g)+O2(g)═2 H2O(g)△H=+485 KJ.mol-1 | ||
| D、2 H2(g)+O2(g)═2 H2O(g)△H=-485 KJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊不消失. | NaAlO2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知PM2.5是指大气中直径≤2.5×10-6 m的颗粒物则PM为2.5的大气一定能产生丁达尔效应 | ||||
| B、根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 | ||||
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | HClO不能制取HCl |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 还原剂的还原性一定大于还原产物 | 工业上通常用钠与熔融氯化钾反应制取钾 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | 自然界闪锌矿PbS遇到CuSO4溶液可以转变为铜蓝CuS |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
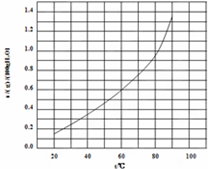
| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的KSP约等于6.25×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.
在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.| 化学键 | H-S | S-S | S=O | H-O |
| 键能/KJ?mol-1 | 364 | 266 | 522 | 464 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com