
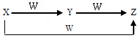
 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )| A. | 仅有①③ | B. | ①②③ | C. | 仅有②④ | D. | ①②③④ |
分析 图中X可连续与W发生反应,X如为单质,应为变价元素,可为C、N、Fe等对应的单质,也可为两性化合物、CO2等,二氧化硫须在催化剂条件下生成三氧化硫,所以单质硫不能一步反应生成三氧化硫,以此解答该题.
解答 解:①X为C、Y为CO,则W为O2,Z为CO 2,且C与O2完全反应即生成CO2,故①正确;
②X、Y分别为S、SO2 ,W为O2,Z为SO3,S与O2反应不能得到SO3,故②错误;
③X、Y分别为AlCl3、Al(OH)3,W为NaOH,Z为NaAlO2,AlCl3可与过量NaOH反应生成NaAlO2,故③正确;
④X、Y分别为Cl2、FeCl3,W为Fe,Z为FeCl2,但Cl2与Fe反应不能得到FeCl2.故④错误.
故选A.
点评 本题考查考查常见元素及其化合物的有关转化,是中等难度的试题,对学生的要求比较高,学生需要有充足的知识储备,以及灵活应变能力,该题也可以通过排除法,进行筛选得到正确的答案.


科目:高中化学 来源: 题型:选择题
| A. | Al3+、K+、SO42-、NO3- | B. | Na+、Mg2+、SO42-、Cl- | ||
| C. | ClO-、I-、K+、Na+ | D. | Ba2+、OH-、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种转化关系中发生的反应都属于化合反应 | |
| B. | 三种转化关系中所有的生成物在常温下都是气体 | |
| C. | 三种物质都只能跟氧气反应转化为二氧化碳 | |
| D. | 三种物质都能在点燃条件下转化为二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证乙烯与溴发生加成反应 | 乙烯通入溴水中,测定反应前后溶液pH |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加铁氰化钾溶液 |
| C | 检验乙酸中是否混有乙醇 | 取样液于试管,加入一绿豆颗粒大的钠粒 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
将1 mol CH4和适量的O2在密闭容器中点燃,充分反应后,CH4和O2均无剩余,且产物均为气体(101 kPa、120℃),总质量为72 g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则不能被完全吸收
B.产物的平均摩尔质量为24 g•mol-1
C.若将产物通过浓硫酸,充分吸收后,浓硫酸增重18 g
D.反应中消耗56 g O2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
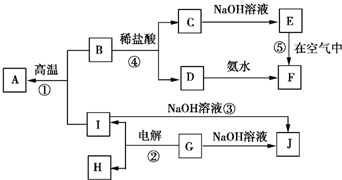
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
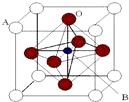 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | 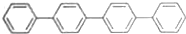 的一氯代物 的一氯代物 | 有5种 |
| D | 蛋白质水解的最终产物 | 多肽 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com