
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
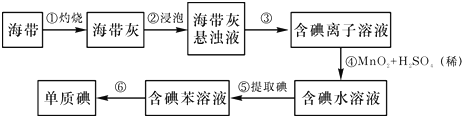
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 大气中的含量 (体积百分比) | 温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
 配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.
配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质 | |
| B. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| C. | 雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 | |
| D. | 将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下:
苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下: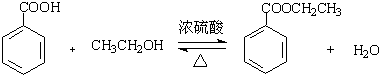 .
.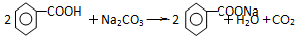 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
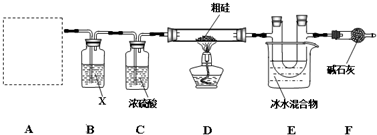
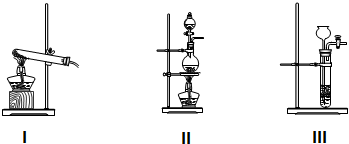
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小容器体积,平衡向右移动 | |
| B. | 加入催化剂,平衡不移动故正逆反应速率不变 | |
| C. | 增大c(X),X的转化率增大 | |
| D. | 降低温度,Y的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com