
 I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.分析 I、(1)依据电镀原理分析,钢铁上镀铝是利用铝做阳极,钢铁做阴极,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度;铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子分析书写离子方程式;
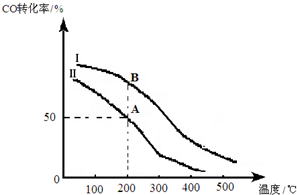
Ⅱ、(1)分析图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向进行分析反应能量变化;
(2)结合投料比较少氢气物质的量,依据化学平衡三段式列式计算平衡浓度,得到A点的平衡常数,AB是相同温度下的平衡,平衡常数只随温度变化分析;
(3)为提高CO转化率,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行.
解答 解:I、(1)依据电镀原理分析,钢铁上镀铝是利用铝做阳极与电源正极相连,钢铁做阴极与电源负极相连,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现,离子液体是一种室温熔融盐,为非水体系,电镀过程中不产生其他离子且有机阳离子不参与电极反应,则阴极反应生成铝是发生的还原反应,铝元素化合价降低,分析离子液体成分,结合电荷守恒分析可知是Al2Cl7-得到电子生成,电极反应为:4Al2Cl7-+3e-=Al+7AlCl4-;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气,2H++2e-=H2↑;
故答案为:负;4Al2Cl7-+3e-=Al+7AlCl4-;H2 ;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度;铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
故答案为:bd;不能;Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+;
Ⅱ、(1)图象可知,一氧化碳转化率随温度升高减小,说明平衡逆向,正反应为放热反应,a<0,
故答案为:<;
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,n(H2)=20mol,
CO(g)+2H2(g)═CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 1 0.5
A点的平衡常数KA =$\frac{0.5}{0.5×1{\;}^{2}}$=1
AB是相同温度下的平衡,平衡常数只随温度变化,所以AB平衡常数相同;
故答案为:1;=;
(3)为提高CO转化率可采取的措施,可以增加氢气量,提高一氧化碳的转化率,反应是放热反应,降低温度平衡正向进行,依据反应特征和平衡移动原理分析提高一氧化碳转化率的条件是平衡正向进行,即减小投料比、较低温度、增大压强、分离出CH3OH;
故答案为:减小投料比、较低温度、增大压强、分离出CH3OH.
点评 本题考查了电解原理的分析应用铝热反应原理分析,化学平衡、平衡常数,反应速率影响因素分析判断,化学平衡计算,化学平衡的建立过程分析应用,掌握基础是关键,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:简答题
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为_________。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O.研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是__________。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(如下图),产生该差异的可能原因是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
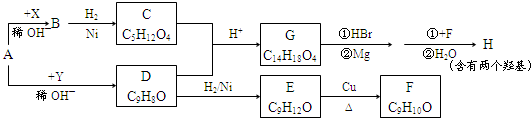
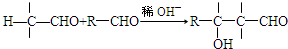
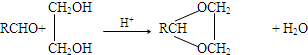
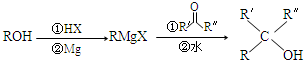
 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式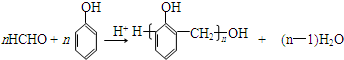 .
.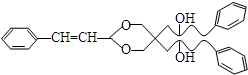 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能消毒杀菌 | |
| B. | 锌可用作锌锰干电池的负极材料 | |
| C. | 糖类、油脂、蛋白质均是有机高分子化合物 | |
| D. | 硅可用于制造太阳能光电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
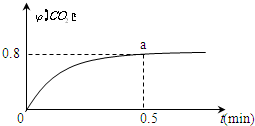 常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
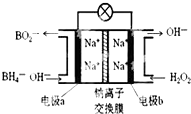 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
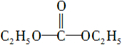 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl常用于保存食物 | |
| B. | 烹鱼时加入少量酒、食醋,美味又营养 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 燃煤中加入CaCO3,可减少SO2气体对大气的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com