
| A. | 原子是由原子核和核外电子构成的 | |
| B. | 保持水的化学性质的粒子是水分子 | |
| C. | 分子的质量总比原子的质量大 | |
| D. | 在化学反应中分子可分而原子不可分 |
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 精炼铜时粗铜做阴极,纯铜做阳极 | |
| B. | 电解MgCl2饱和溶液,可制得金属镁 | |
| C. | 钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe-3e-═Fe3+ | |
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 用氯化铁溶液腐蚀铜板:Fe3++Cu═Cu2++Fe2+ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数由少到多的顺序:X=W<Y<Z | |
| B. | 原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z) | |
| C. | 元素非金属性由强到弱的顺序:X、Y、W | |
| D. | 元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
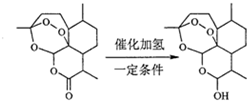
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
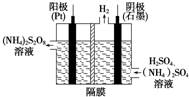 (1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.
(1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥⑦ | B. | ①②⑤⑦⑧ | C. | ②③④⑤⑥ | D. | ①③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
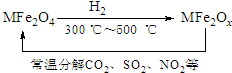 新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:
新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把SO2通入紫色石蕊溶液中,石蕊溶液 会变红 | |
| B. | 把SO2通入品红溶液中,品红溶液会褪色 | |
| C. | 将足量SO2通入酸性高锰酸钾溶液中,溶液褪色 | |
| D. | 把SO2通入氯化钡溶液中,溶液会出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com