
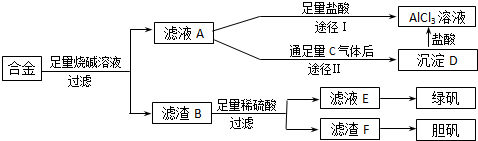
分析 含有铝、铁、铜的合金加入氢氧化钠溶解,只有铝与氢氧化钠反应生成偏铝酸钠和氢气,所以滤渣B为铁和铜,再经稀硫酸反应过滤的滤液为氯化亚铁,进一步转化成绿矾,滤渣F为铜单质,进一步转化成胆矾;滤液A则为偏铝酸钠溶液,加过量盐酸经途径Ⅰ生成氯化铝溶液,而滤液A通足量气体C经途径Ⅱ生成沉淀D,根据氢氧化铝只溶于强酸强碱,所以气体C为二氧化碳,沉淀D为氢氧化铝,与盐酸反应生成氯化铝溶液,
(1)根据以上分析,该流程需要过滤操作,所以需的玻璃仪器为烧杯、玻璃棒、漏斗;
(2)根据所发生的反应来确定溶液的组成情况,并书写发生的反应,铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠;
(3)根据反应所得产物的组成来选择合适的制取方案,途径Ⅰ偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而途径Ⅱ向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝;
(4)溶液得到溶质晶体的实验操作为,蒸发浓缩、冷却结晶、过滤洗涤;
(5)根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
解答 解:含有铝.铁.铜的合金加入氢氧化钠溶解,只有铝与氢氧化钠反应生成偏铝酸钠和氢气,所以滤渣B为铁和铜,再经稀硫酸反应过滤的滤液为氯化亚铁,进一步转化成绿矾,滤渣F为铜单质,进一步转化成胆矾;滤液A则为偏铝酸钠溶液,加过量盐酸经途径Ⅰ生成氯化铝溶液,而滤液A通足量气体C经途径Ⅱ生成沉淀D,根据氢氧化铝只溶于强酸强碱,所以气体C为二氧化碳,沉淀D为氢氧化铝,与盐酸反应生成氯化铝溶液;
(1)根据以上分析,该流程需要过滤操作,所以需的玻璃仪器为烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)途径Ⅰ偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而途径Ⅱ向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,所以途径Ⅱ更合理;
故答案为:Ⅱ;因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液;
(4)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,过滤洗涤即可得到绿矾,
故答案为:蒸发浓缩、冷却结晶、过滤洗涤;
(5)铜不能和稀硫酸反应,贴可以和硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O,故答案为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O.
点评 本题是对物质的分离和提纯知识点的考查,题目难度中等,可以根据所学的知识进行,掌握基础是解题关键.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 一种元素可能有多种氧化物,但同一化合价只对应一种氧化物 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸呈红色的溶液中:Na+、AlO2-、NO3-、CO32- | |
| B. | 遇苯酚溶液显紫色的溶液:Na+、SO32-、S2-、Cl- | |
| C. | 含有0.1 mol•L-1 HCO3-的溶液:Na+、K+、NO3-、C6H5O- | |
| D. | 水电离出的H+浓度为1.0×10-12 mol•L-1的溶液:Na+、Fe3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 nm左右 | B. | 50 nm左右 | C. | 0.001 mm左右 | D. | 100 mm左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
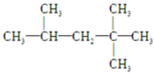 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为
;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为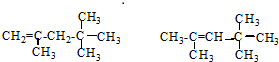 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:1720Cl | B. | S2-的结构示意图: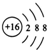 | ||
| C. | 四氯化碳的电子式: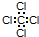 | D. | 乙醇的结构式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com