
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
【答案】D
【解析】
A、冰醋酸是共价化合物,是由分子组成,不含阴阳离子,故A错误;
B、CCl4在标准状况下不是气体,不能直接用22.4L·mol-1计算,故B错误;
C、假设46g全部是NO2,则含有分子物质的量为![]() =1mol,假设全部是N2O4,则含有分子物质的量为
=1mol,假设全部是N2O4,则含有分子物质的量为![]() =0.5mol,因此两者混合物所含分子物质的量应在0.5mol和1mol之间,故C错误;
=0.5mol,因此两者混合物所含分子物质的量应在0.5mol和1mol之间,故C错误;
D、铜和浓硝酸反应Cu+4HNO3(浓)=Cu((NO3)2+2NO2↑+2H2O,如果Cu和稀硝酸反应3Cu++8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据量的关系,Cu全部参与反应,即转移电子物质的量为![]() =1mol,故D正确;
=1mol,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
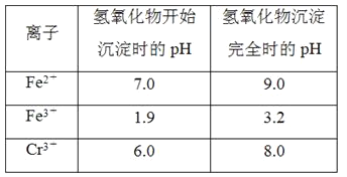
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
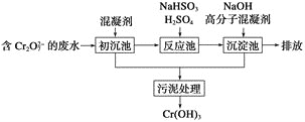
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
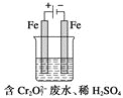
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等方面具有十分广泛的应用。
Ⅰ.工业生产精细化工产品乙二醛(OHC—CHO)
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,此反应的化学方程式为_____________,该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点: ___________________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:2H2(g)+O2(g) 2H2O(g) ΔH=-484 kJ/mol,化学平衡常数为K1。
OHC—CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78 kJ/mol,化学平衡常数为K2。
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC—CHO(g)+2H2O(g)的ΔH=______。相同温度下,该反应的化学平衡常数K=_______(用含K1、K2的代数式表示)。
②当原料气中氧醇比为4∶3时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495 ℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____________、___________。
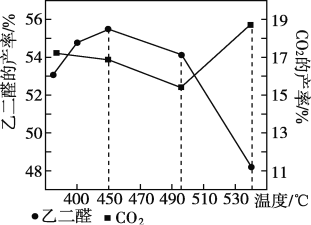
Ⅱ.副产物CO2的再利用
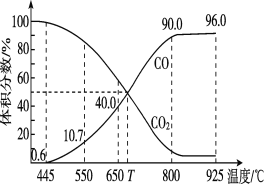
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
A.550℃时,若充入氢气,则v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25%
C.T℃时,若再充入等物质的量的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
已知:计算用平衡分压代替平衡浓度,气体分压(p分)=气体总压(p总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MnO2![]() Cl2
Cl2![]() SiCl4
SiCl4
B. Ca(ClO)2![]() HClO
HClO![]() HCl
HCl
C. 浓H2SO4![]() SO2
SO2![]() BaSO4
BaSO4
D. SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
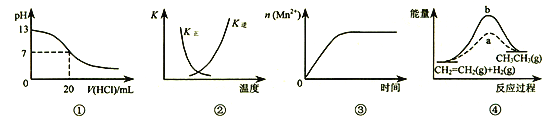
A. 图①表示25℃时,用0.1mol/L盐酸滴定20 mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol/L KMnO4 酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用,且是放热反应)
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是( )
A. 第二阶段,Ni(CO)4分解率较高
B. 该反应达到平衡时,4v(Ni(CO)4)生成=v(CO)生成
C. 增加c(CO),平衡向正向移动,反应的平衡常数增大
D. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸烟有害健康,烟草中的剧毒物尼古丁的结构简式如右图所示,有关其叙述正确的是( )
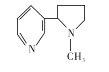
A. 尼古丁分子中的六元环不是正六边形
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 该有机物属于芳香族化合物
D. 尼古丁的一氯代物有10种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com