
分析 (1)燃烧热指1mol物质完全燃烧生成稳定的氧化物的反应热,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和热指稀溶液中酸与碱反应生成1molH2O的反应热热量;
(2)利用盖斯定律计算,将(2)×2+(3)-(1),可得 2C(s)+2H2(g)+O2(g)═CH3COOH(l),反应热随之相加减,可求得反应热;
(3)根据燃烧热的定义判断.
解答 解:(1)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热,
B.碳燃烧的生成物为CO,表示温度的氧化物CO2,反应热△H2不能表示燃烧热,
C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热,
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热,
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热,
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热,
G.反应生成的水为2mol,反应热△H7不能表示中和热,
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8是酸与碱反应生成1molH2O,符合中和热概念,反应热△H8能表示中和热,
故答案为:D E; FH;
(2)已知:①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③2H2(g)+O2(g)═2H2O(l)△H3=-285.8kJ/mol
利用盖斯定律,将②×2+③-①,可得 2C(s)+2H2(g)+O2(g)═CH3COOH(l),
则:△H=2×(-393.5kJ/mol)+(-285.8kJ/mol)-(-870.3kJ/mol)=-202.5 KJ/mol,
故答案为:-202.5 KJ/mol;
(3)1mol氢气在氧气中充分燃烧生成液态水时释放出285.8kJ的热量,生成物为稳定状态,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol.
点评 本题考查燃烧热与中和热的概念、反应热的有关计算、热化学方程式的意义等,为高频考点,注意中和热与燃烧热概念的把握,注意把握盖斯定律的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | RCl | B. | RCl2 | C. | RCl3 | D. | RCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
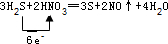 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
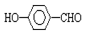 的沸点比
的沸点比 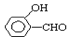 高,原因是:
高,原因是: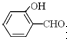 形成分子内氢键,而
形成分子内氢键,而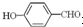 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | 浓度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,0.1mol/LHA溶液的pH=1 | B. | 0.1mol/LHA溶液中:c(HA)>c(A-) | ||
| C. | ①溶液中:c(HA)+c(A-)=0.1mol/L | D. | ①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com