
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用 过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度_______________;
(2)产生的气体在标准状况下的体积_____________。(要有过程)
【答案】 Na2CO3的物质的量浓度为1.0mol/L,Na2SO4的物质的量浓度为0.4mol/L 二氧化碳的体积为1.12L
【解析】试题分析:沉淀用过量稀HNO3处理后,剩余的4.66 g必为BaSO4,由SO42-守恒知,n(Na2SO4)=n(BaSO4)=![]() =0.02mol,则c(Na2SO4)=
=0.02mol,则c(Na2SO4)=![]() =;而m(BaCO3)=14.51g-4.66g=9.85g,由CO32-守恒知,n(Na2CO3)=n(BaCO3)=
=;而m(BaCO3)=14.51g-4.66g=9.85g,由CO32-守恒知,n(Na2CO3)=n(BaCO3)=![]() =0.05mol,则c(Na2CO3)=
=0.05mol,则c(Na2CO3)=![]() (2)由C原子守恒知,n(CO2)=n(CO2-3)="0.05" mol,所以V(CO2)="0.05" mol×22.4 L/mol=1.12L.
(2)由C原子守恒知,n(CO2)=n(CO2-3)="0.05" mol,所以V(CO2)="0.05" mol×22.4 L/mol=1.12L.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 淀粉在人体内能水解成葡萄糖 B. 纤维素和淀粉遇碘水均呈蓝色
C. 葡萄糖和淀粉均属于高分子化合物 D. 凡含有食品添加剂的食物均不可食用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列关于溶液中的量的关系判断正确的是
A. H+浓度:10c(H+)甲=c(H+)乙 B. OH-浓度:c(OH-)甲=10c(OH-)乙
C. 溶液浓度:c(甲)>10c(乙) D. 与等量NaOH反应耗酸体积:10V(甲)>V(乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,以氮气为原料的合成氨工业可以实现大规模固氮,氨可用于生成氯化铵、硫酸铵等化学肥料。
(1)科学家已成功合成少量N4分子,N4和N2互为_____,NH3分子的空间构型为型______。
(2)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标况下)氮气,至少需要叠氮酸钠_____g,转移电子____个。
(3)检验铵态氮肥中铵根离子的实验方案是(补充写出步骤,现象):取样,溶于水_________________________________________________。
(4)等物质的量浓度的两溶液,pH大小为:氯化铵__________硫酸铵(选填>、=或< ,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵_____硫酸铵;
最新“人工固氮”的研究报道:常温常压、催化剂条件下, N2在催化剂表面与水发生反应:与水发生反应: 2N2(g)+6H2O(g)![]() 4NH3(g)+3O2(g)-Q,(Q>0)
4NH3(g)+3O2(g)-Q,(Q>0)
(5)如果反应的平衡常数K值变小,该反应正反应速率_______ (选填增大、减小或不变,下同),逆反应速率_______.
(6)若反应在恒容条件下进行,请用上述反应中的有关物理量来说明该反应已达到平衡状态_______.
(7)下列能够提高氮气转化率的措施是:_____
A.适当升高温度 b.增加水的用量
C.使用高效催化剂 d.扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于(NH4)2SO4溶液,下列说法正确的是
A. 溶液中存在电离平衡:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B. 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大
C. 加水稀释,溶液中所有离子的浓度均减小
D. 溶液中:c(SO42-)=2c(NH4+)+2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.含有少量氯化钠的硝酸钾粉末,可采用冷却热饱和溶液的结晶法进行提纯
B.实验室中少量金属钠常保存在煤油中,实验时多余的钠不能放回原试剂瓶中
C.铁丝能代替铂丝做焰色反应实验
D.苯不能用带橡胶塞的试剂瓶贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为____,放电生成的固体会附聚在电极表面,工作过程中若正极质量增重96g时,理论上电路中转移的电子数为____。
(2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为_______。
(3)某实验小组同学对电化学原理进行了一系列探究活动。
①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)_____设计的原电池装置
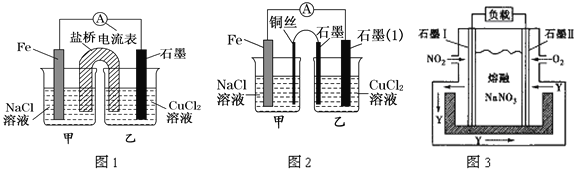
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。
在甲装置中铜电极反应为_______________;乙装置中石墨(1)为________极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为_________________.
③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com