
����Ŀ���ҹ��涨�����ڼ�ȩ�������ó���0.08mgm��3��ij�о���ѧϰС������������KMnO4��Һ�ⶨ�����м�ȩ�ĺ���������Э������������ѧϰ������װ����ͼ�����䷴Ӧԭ�����������£�
4MnO4��+5HCHO+H+�TMn2++5CO2��+11H2O
2MnO4��+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O
���裺����ȡ5.00mL 1.00��10��3molL��1 KMnO4����Һ��ϴ��ƿ�У������뼸��ϡH2SO4����ˮ20mLϡ�ͱ�����
��ȡ1.00��10��3molL��1�������Һ����ʽ�ζ����б�����
����ע������ȡ100mL��װ�����ڿ������ٽ�ע������������ϴ��ƿ�г�ַ�Ӧ�����ظ�4����
�ܽ�ϴ��ƿ����Һת�Ƶ���ƿ�У�����ϴ��Һ�������ñ�������Һ���еζ�����¼�ζ������ĵIJ�����Һ�������
�����ظ�ʵ��2�Σ�ÿ��ȡ���������Һ5.00mL����3��ʵ�����IJ�����Һ�����ƽ��ֵΪ12.38mL��

�ش���������
��1��5.00mL���������_____��ȡ��
��2����ʵ����ָʾ��_____������ĸ����
a���ȡ�b��̪��c���ۡ�d�������������Լ�
��3������þ����ڿ����м�ȩ��Ũ��_____mgm��3��
��4�����в������������ڼ�ȩŨ��ƫ�ߵ���_____��
a���ζ��յ㸩�Ӷ���
b���ζ�ǰ�����ݵζ���������
c���ڸ��������Һ�м�������ˮ
d��װ����ĵζ���δ��ϴ
��5�������Ƕ�Ԫ��ǿ�ᣬ����������Һ�����ԣ������£������10 mL 0.01molL��1H2C2O4��Һ�еμ�0.01 molL��1NaOH��Һ
�ٵ������NaOH��Һ���Ϊ10mL������д����Һ�������غ��ϵʽ_____��
�ڵ������NaOH��Һ���Ϊ20mL������д����Һ�����ӵ�Ũ�ȴ�С��ϵ_____��
���𰸡� ��ʽ�ζ��� d 18 a c��H+��+c��H2C2O4��=c��OH����+c��C2O42���� c��Na+����c��C2O42������c��OH������c��HC2O4������c��H+��
����������1�����⿼��ζ�ʵ�飬ע��ζ���ѡȡ�����ķ����� ���������Һ����ǿ�����ԣ���ʽ�ζ����¶���һ����������ض����и�ʴ�ԣ���˸������ʢ������ʽ�ζ����У���2�����������Һ��������ɫ����˲���Ҫָʾ������ѡ��d��ȷ����3���������ӷ�Ӧ����ʽ������ᷴӦ�ĸ�����ص����ʵ���Ϊ12.38��10��3��1��10��3��2/5mol=4.952��10��6mol�����ݸ���������ȩ��Ӧ�����ӷ�Ӧ����ʽ�����ļ�ȩ�����ʵ���Ϊ��5��10��3��1��10��3��4.952��10��6����5/4mol=6��10��8mol��������Ϣ������ȡ����500ml����˼�ȩ��Ũ��Ϊ6��10��8��30��103/500��10��6mg/m3=3.6 mg/m3����4��a���ζ�ʱ���Ӷ��������IJ���������С�������ȩ��Ӧ�ĸ�����ص������ӣ������ļ�ȩ��Ũ��ƫ�ߣ�����ȷ��b���ζ�ǰ�����ݵζ��������ݣ����IJ����������ӣ����ȩ��Ӧ�ĸ�����ص�����С�������ļ�ȩ��Ũ��ƫ�ͣ��ʴ���c�����������Һ��ˮ��������ص����ʵ������䣬���ȩ��Ũ�Ȳ��䣬�ʴ���d��ʢװ����ĵζ���Ϊ��ϴ�������Ũ��ƫС�����IJ��������������ȩ��Ӧ�ĸ�����ص�����С����ļ�ȩ��Ũ��ƫ�ͣ��ʴ���5�����⿼������Ũ�ȴ�С�ıȽϣ���������ʵ��������ˮ���ص����֣�һ���֣�������������NaOH10mL����Һ������ΪNaHC2O4�������غ㣺c(Na��)=c(HC2O4��)��c(C2O42��)��c(H2C2O4) ������غ㣺c(Na��)��c(H��)=c(HC2O4��)��c(OH��)��2c(C2O42��)����������غ�Ϊ�� c(H��)+ c(H2C2O4)= c(OH��)+ c(C2O42��) ����������NaOH�����Ϊ20mLʱ����Һ������ΪNa2C2O4��C2O42������ˮ�⣺C2O42����H2O ![]() HC2O4����OH������Һ�Լ��ԣ�����ˮҲ�������룬H2O
HC2O4����OH������Һ�Լ��ԣ�����ˮҲ�������룬H2O ![]() H����OH��������ˮ��ij̶������������Ũ�ȴ�С˳���ǣ�c(Na��)��c(C2O42��)��c(OH��)��c(HC2O4��)��c(H��)��
H����OH��������ˮ��ij̶������������Ũ�ȴ�С˳���ǣ�c(Na��)��c(C2O42��)��c(OH��)��c(HC2O4��)��c(H��)��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2ͨ��BaCl2��Һ�в�����������������ͼ�Ҳ��Y�ι��з��ú��ʵ�ҩƷ�����к�����������BaCl2��Һ�п��Կ�����ɫ�������Ҳ�Y�ι��зŵ�ҩƷ��

A. Cu��Ũ���� B. CaO��Ũ��ˮ C. Na2SO3�ͽ�Ũ���� D. KMnO4��Һ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ������
��1����CO2�뽹̿��������CO��CO��������������
��֪��
Fe2O3��s��+3CO��s��ʯī���T2Fe��s��+3CO2��g����H1=+489.0kJmol��1
C��s��ʯī��+CO2��g���T2CO��g����H2=+172.5kJmol��1
��CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪ_____��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H
CH3OH��g��+H2O��g����H
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ��Ӧ�����в�ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�ġ�H____0�����������������=������ͬ����
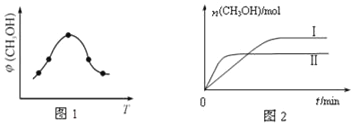
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ������I������Ӧ��ƽ�ⳣ����ϵΪK��_____K����
��3����CO2Ϊԭ�ϻ����Ժϳɶ���������
�ٹ�ҵ������[CO��NH2��2]��CO2��NH3��һ�������ºϳɣ���ʼ��̼��![]() =3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ_____��
=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ_____��
�ڽ�����CO2ͨ�뱥�Ͱ�ˮ�пɵõ���NH4HCO3����֪������һˮ�ϰ�Kb=1.8��10��5��̼��һ�����볣��Ka=4.3��10��7����NH4HCO3��Һ��_____������ԡ��������ԡ����ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʼ��ת����ϵ��ȷ���ǣ� ��
A.FeCl2��aq�� ![]() FeCl3��aq��
FeCl3��aq�� ![]() FeCl2��aq��
FeCl2��aq��
B.H2SO3 ![]() Si02
Si02 ![]() SiCl4
SiCl4
C.NaCl��aq�� ![]() NaHC03��s��
NaHC03��s�� ![]() Na2CO3��s��
Na2CO3��s��
D.CuS04 ![]() Cu��OH��2
Cu��OH��2 ![]() Cu
Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʰ��ᡢ��η���˳��������ȷ����
A. ���ᡢ���ʯ�� B. ̼�ᡢ�Ҵ���������
C. �����ᡢ�ռ���� D. ���ᡢ��ʯ�ҡ����Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥMgCl2��Һ�е�Fe3+,���ڼ��Ƚ���������¼����һ���Լ���(����)
A.NaOHB.Na2CO3C.��ˮD.MgO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CuSO4��Һ�ֱ���Na2CO3��Һ��Na2S��Һ�ķ�Ӧ���������
(1)CuSO4+Na2CO3
��Ҫ��Cu2++CO32��![]() +H2O��Cu(OH)2��+CO2�� ��Ҫ��Cu2++ CO32����CuCO3��
+H2O��Cu(OH)2��+CO2�� ��Ҫ��Cu2++ CO32����CuCO3��
(2)CuSO4+Na2S
��Ҫ��Cu2++S2����CuS�� ��Ҫ��Cu2++S2��+2H2O��Cu(OH)2��+H2S��
���м������ʵ��ܽ�ȴ�С�ıȽ�������ȷ����( )
A. Cu(OH)2>CuCO3>CuS B. CuS>Cu(OH)2>CuCO3
C. CuS<Cu(OH)2<CuCO3 D. Cu(OH)2<CuCO3<CuS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������˵��������ǣ� ��
A. ��״̬�£�1LSO3���еķ�����ΪNA/22.4
B. 17gOH-�к��еĵ�����Ϊ10NA
C. 46g����������46g�������������е�ԭ������Ϊ3NA
D. ���³�ѹ�£�34gH2O2�к��й��õ��Ӷ���Ϊ3NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��������Ԫ�ص�ԭ���������������Ҿ�С��18��Aԭ�ӵ��������ӱ�Bԭ�ӵ�����������2����Bԭ�ӵ�������������Ӳ�����4����A��B��C����Ԫ���ܽ�ϳɻ�����C2AB3 �� ��1mol C2AB3�й���52mol���ӣ�DԪ�صĵ���0.5mol����ȫ����Ӧ��ʱ����9.03��1023������ת�ƣ�EԪ�صĵ�����һ�ֻ���ɫ���壬ˮ��Һ����Ư���ԣ�����д���пհף�
��1��д��Ԫ��A��E�����ƣ�A �� E ��
��2��Ԫ��B�����ڱ��е�λ��Ϊ�ڶ������壮
��3����Ԫ��B��C�γɵ�һ�ֻ����������Ϊ������ߵĹ��������û�����Ϊ������������ԡ��Ǽ��ԡ��������������ӡ����ۡ�����д���û�����ĵ���ʽ ��
��4��д��C��D����Ԫ�ض�Ӧ������������ˮ�������Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com