
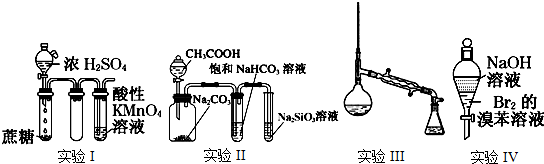
分析 (1)浓硫酸能够将蔗糖脱水生成碳,碳与浓硫酸反应生成二氧化硫,通过酸性高锰酸钾溶液褪色判断产生了二氧化硫,从而证明浓硫酸具有强氧化性;
(2)醋酸与碳酸钠反应生成二氧化碳气体,二氧化碳与硅酸钠溶液反应生成硅酸沉淀,证明了酸性:醋酸>碳酸>硅酸;由于醋酸具有挥发性,会干扰二氧化碳与硅酸钠的反应,所以用碳酸氢钠溶液除去醋酸;
(3)蒸馏操作中冷凝管应该选用直形冷凝管;
(4)根据图示可知,实验目的是除去溴苯中混有的杂质溴.
解答 解:(1)蔗糖被浓硫酸脱水生成碳,碳与浓硫酸发生氧化还原反应生成二氧化硫气体,盛有酸性高锰酸钾溶液的试管中脱水,证明产生了二氧化硫,则证明了浓硫酸具有强氧化性,
故答案为:能;
(2)实验Ⅱ中,醋酸与碳酸钠反应生成二氧化碳,二氧化碳与硅酸钠反应生成硅酸,证明证明了酸性:CH3COOH>H2CO3>H2SiO3;由于醋酸具有挥发性,从而干扰了二氧化碳与硅酸钠的反应,所以用饱和碳酸氢钠溶液吸收挥发的醋酸,防止干扰CO2与硅酸钠溶液的反应,
故答案为:酸性:CH3COOH>H2CO3>H2SiO3;吸收挥发的醋酸防止干扰CO2与硅酸钠溶液的反应;
(3)蒸馏操作中冷凝器的作用是冷凝气体为液体,故应该采用的是直形冷凝管,实验Ⅲ蒸馏仪器中错误之处是没有用直形冷凝管,
故答案为:没有用直形冷凝管;
(4)溴与溴苯互溶,氢氧化钠溶液能够与溴反应,根据图示可知,实验Ⅳ的目的是将溴转化成不溶于溴苯的无机盐,从而除去溴苯中杂质溴,
故答案为:除去溴苯中的溴.
点评 本题考查了浓硫酸的性质、化学实验基本操作方法的应用及判断,题目难度中等,注意掌握浓硫酸具有的性质,明确化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油是含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| D. | 煤含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 | |
| B. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
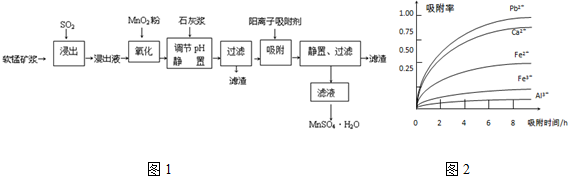
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 初步分离酒精和水的混合物(蒸发) | |
| B. | 除去FeCl2溶液中的少量铁粉(过滤) | |
| C. | 提纯NaCl和KNO3的混合物中的KNO3(萃取) | |
| D. | 分离溴的四氯化碳溶液中的溴(分液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com