
| A. | 钠浮在液面上 | B. | 四处游动 | C. | 水溶液变为红色 | D. | 熔化成小球 |
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2→HClO→NaClO | B. | Fe→Fe2O3→Fe(OH)3 | ||
| C. | S→SO3→H2SO4 | D. | NH3→NO2→HNO3→NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | B. | 地下钢管连接锌板 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 金属护拦表面涂漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO不溶于水,是一种大气污染物 | |
| B. | NO是一种红棕色的有毒气体 | |
| C. | NO结合血红蛋白的能力比CO还强 | |
| D. | NO与氧气反应生成NO2,体现其还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
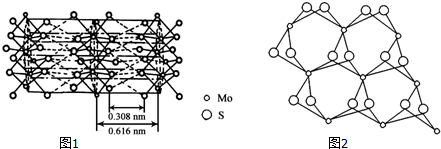
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
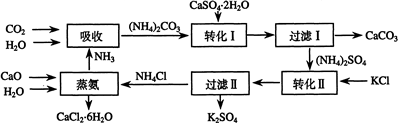
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com