
【题目】Ni-MH电池在工农业生产和日常生活中具有广泛用途,废旧电池中含有大量金属元素,其回收利用具有非常重要的意义。一种利用废Ni-MH电池正极材料(主要含有Ni(OH)2,还含有少量Fe、Cu、Ca、Mg、Mn、Zn的氢氧化物)制备电子级硫酸镍晶体的工艺流程如下图所示:

回答下列问题:
(1)“浸出”时温度、硫酸浓度、浸出时间对镍浸出率的影响如下图:

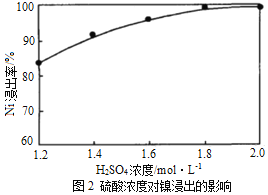
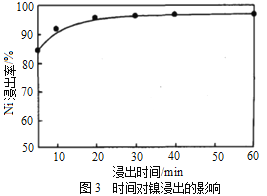
则“浸出”时最适宜的条件为_______________。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:______________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+)∶c(Ca2+)=0.67,则MgF2的溶度积为_____________[已知Ksp(CaF2)=1.10×10-10]。
(4)向“滤液3”中加入(NH4)2S2O8可以除锰,在此过程中(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、硫酸铵及硫酸,写出该反应的化学方程式___________________。
(5)向“滤液4”加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为:Zn2++4HA![]() ZnA2·2HA+2H+
ZnA2·2HA+2H+
①已知加入萃取剂后,锌的萃取率随料液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是___________________。
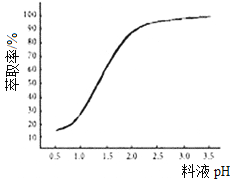
②“操作X”的名称是_____________。
(6)上述回收镍的过程中,使用了1kg含镍37.1%的正极材料,最终得到纯净的NiSO4·7H2O1.686kg,则镍的回收率为_______________。
【答案】 80℃ ,1.8mol/LH2SO4,30min 2Fe2++H2O2+2H2O=2FeOOH↓+4H+ 7.37×10-11 (NH4)2S2O8+MnSO4+2H2O=MnO2↓+(NH4)2SO4+2H2SO4 料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大 分液 95.4%
ZnA2·2HA+2H+向右进行,锌的萃取率增大 分液 95.4%
【解析】分析:本题以利用废Ni-MH电池正极材料制备电子级硫酸镍晶体的工艺流程为载体,考查流程的分析、图像分析、适宜条件的选择、外界条件对化学平衡的影响、指定情境下方程式的书写、溶度积的计算、化学实验的基本操作和化学计算。废Ni-MH电池正极材料加H2SO4浸出时,金属的氢氧化物转化成相应的硫酸盐;浸出液中加入Na2S将Cu2+转化为CuS沉淀除去;向“滤液1”中加入双氧水将Fe2+转化为FeOOH沉淀除去;向“滤液2”中加入NaF将Ca2+、Mg2+转化为CaF2、MgF2沉淀而除去;向“滤液3”中加入(NH4)2S2O8除去Mn2+;“滤液4”中用有机萃取剂除去Zn2+。
详解:(1)根据图1,“浸出”最佳温度约为80℃;根据图2,随着硫酸浓度的增大Ni浸出率增大,硫酸浓度为1.8mol/L时Ni浸出率已经很大,当硫酸浓度大于1.8mol/L,继续增大硫酸浓度Ni浸出率增大不明显,硫酸最适宜浓度为1.8mol/L;根据图3,“浸出”时间小于30min随着时间的延长Ni浸出率明显增大,大于30minNi浸出率趋于平缓,最佳时间为30min;“浸出”时最适宜的条件是:温度为80℃、硫酸浓度为1.8mol/L、时间为30min。
(2)双氧水将Fe2+转化为FeOOH沉淀,Fe2+被氧化,H2O2被还原,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH↓+4H+。
(3)当加入过量NaF后,Ksp(MgF2)=c(Mg2+)·c2(F-),Ksp(CaF2)= c(Ca2+)·c2(F-),将两式相比消去c2(F-),Ksp(MgF2)= Ksp(CaF2)![]() =1.10
=1.10![]() 10-10
10-10![]() 0.67=7.37
0.67=7.37![]() 10-11。
10-11。
(4)(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、(NH4)2SO4和H2SO4,含锰元素的黑色不溶物为MnO2,反应可写成(NH4)2S2O8+MnSO4→MnO2↓+(NH4)2SO4+H2SO4,Mn元素的化合价由+2价升至+4价,S元素的化合价由+7价降至+6价,根据得失电子守恒和原子守恒配平,(NH4)2S2O8与MnSO4反应的化学方程式为:(NH4)2S2O8+MnSO4+2H2O=MnO2↓+(NH4)2SO4+2H2SO4。
(5)①pH增大时,锌的萃取率逐渐增大的原因是:料液pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大。
ZnA2·2HA+2H+向右进行,锌的萃取率增大。
②“滤液4”中加入有机萃取剂将Zn2+萃取,出现分层现象,将有机层与水层分离的“操作X”的名称为分液。
(6)根据Ni守恒,Ni的回收率为![]() 100%=95.4%。
100%=95.4%。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应3H2+N22NH3 , 下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.使用高效催化剂
B.充入更多N2
C.降低温度
D.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“民以食为天,食以安为先”,下列做法会危害食品安全的是
A. 回收餐桌废油加工成化工原料 B. 给蔬菜瓜果喷洒甲醛溶液
C. 做菜时加适量的酱油调味細味 D. 用食盐作食物防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
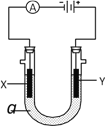
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①在X极附近观察到的现象是________________________。
②Y电极上的电极反应式为________________________,检验该电极反应产物的方法是_____________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是__________,电极反应式是_______________________________________。
②Y电极的材料是__________,电极反应式是_______________________________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( )
A. KX、KZ、KY B. KX、 KY、KZ
C. KZ、KY 、KX D. KY、KZ、KX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,正确的是( )
A. 少量金属钠密封保存在水中
B. 新制的氯水通常保存在无色试剂瓶中
C. 氢氧化钠溶液保存在有玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在塑料瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)可作汽车尾气CO、NO和HC(碳氢化合物)转化的催化剂。Pd负载量不同或不同工艺制备的纳米Pd对汽车尾气处理的结果如下图所示。下列说法不正确的是
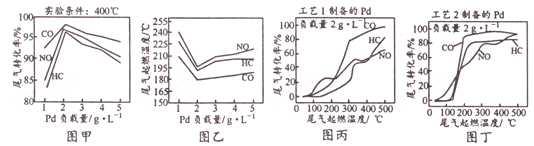
A. 图甲表明,其他条件相同时,三种尾气的转化率随Pd负载量的增大先升后降
B. 图乙表明,尾气的起燃温度随Pd负载量的增大先降后升
C. 图甲和图乙表明,Pd负载量越大催化剂活性越高
D. 图丙和图丁表明,工艺2制得的催化剂Pd的性能优于工艺1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
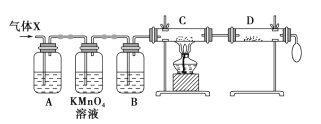
(1)A中加入的试剂可能是_________,KMnO4 溶液的作用是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是:C中 _____________,D中______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com