
在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为________________________________________________________________________。
(2)用c、d来表示该温度下NaOH的溶解度(S)为________________________________________________________________________。
(3)用m、V表示溶液中溶质的物质的量浓度(c)为________________________________________________________________________。
(4)用w、d表示溶液中溶质的物质的量浓度(c)为________________________________________________________________________。
(5)用c、d表示溶液中溶质的质量分数(w)为________________________________________________________________________。
(6)用S表示溶液中溶质的质量分数(w)为________________________________________________________________________。
(7)用S、d表示溶液中溶质的物质的量浓度(c)为________________________________________________________________________。
科目:高中化学 来源: 题型:
下列关于离子键的说法中正确的是( )
A.离子键一定在活泼金属和活泼非金属元素的原子之间形成
B.形成离子键时离子间的静电作用指的是静电吸引
C.形成离子键时,离子半径越大离子键就越强
D.非金属元素的原子之间也可以形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA( )
(2)标准状况下,22.4 L NO2气体中所含分子数目为NA( )
(3)100 g 17%的氨水,溶液中含有的NH3分子数为NA( )
(4)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温下,9 g H2O中含NA个O—H键
B.1 mol Fe2+与足量稀硝酸反应,转移3NA个电子
C.常温常压下,22.4 L SO2和O2的混合气体中含2NA个氧原子
D.0.1 mol·L-1KAl(SO4)2溶液中含0.2NA个SO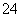
查看答案和解析>>
科目:高中化学 来源: 题型:
在120 ℃时分别进行如下四个反应:
A.2H2S+O2===2S↓+2H2O
B.2H2S+3O2===2SO2+2H2O
C.C2H4+3O2—→2CO2+2H2O
D.C4H8+6O2—→4CO2+4H2O
(1)若反应在容积固定的密闭容器内进行,反应前后气体密度(d)和气体总压强(p)同时符合关系式d前=d后和p前>p后的是________;符合关系式d前=d后和p前=p后的是________(填反应代号)。
(2)若反应在压强恒定、容积可变的密闭容器内进行,反应前后气体密度(d)和气体体积(V)同时符合关系式d前>d后和V前<V后的是________;符合关系式d前>d后和V前>V后的是________(填反应代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是________(填序号,下同)。
①q=2p ②q>2p
③q<2p ④无法确定
(2)若上题中的溶质是乙醇而非硫酸,则p、q的关系是________。
①q=2p ②q>2p
③q<2p ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
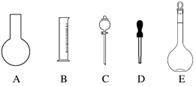
(1)如图所示的仪器中配制溶液肯定不需要的是________________________________________________________________________
(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
非晶体指内部微粒排列呈现杂乱无章的分布状态的固体。下列关于非晶体的叙述中,错误的是( )
A.是物质的一种聚集状态 B.内部微粒的排列是长程无序和短程有序的
C.非晶体材料的所有性能都优于晶体材料 D.金属形成的合金也有非晶体的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com