
| A. | a2<a3<a1<a4 | B. | a3=a2<a1<a4 | C. | a2=a3<a4<a1 | D. | a1<a2<a3<a4 |
分析 C(H+)•C(OH-)=Kw,纯水溶液中氢离子浓度始终等于氢氧根离子浓度,温度不变,水的离子积常数不变.
在25℃时,纯水的电离度为α1,水电离出的c(H+)=c(OH-)=1×10-7mol•L-1;
pH=3的盐酸中C(H+)=10-3mol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,求得水电离出的C(H+)=C(OH-)=10-11mol/L,水的电离度为α2;
pH=11的氨水溶液中C(H+)=10-11mol/L,水电离出的C(H+)=C(OH-)=10-11mol/L,水的电离度为α3;
pH=3的盐酸和pH=11的氨水等体积混合,NH3•H2O+HCl═NH4Cl+H2O,酸碱中和反应放热,促进水的电离,生成的盐为强酸弱碱盐,水解促进水的电离,所得溶液中水的电离度为α4,据此分析解答.
解答 解:在25℃时,纯水中H2O?H++OH-,Kw=C(H+)•C(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7mol•L-1,纯水的电离度为α1;酸碱抑制水的电离,水解的盐促进水的电离;
pH=3的盐酸中C(H+)=10-3mol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,所以溶液中C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,溶液中C(OH-)来自于水的电离,水电离出的C(H+)=C(OH-)=10-11mol/L,pH=3的盐酸中水的电离度为α2,α2<α1;
pH=11的氨水溶液中C(H+)=10-11mol/L,溶液中C(H+)来自于水的电离,水电离出的C(H+)=C(OH-)=10-11mol/L,pH=11的氨水溶液中水的电离度为α3,α3=α2<α1;
盐酸为强电解质,pH=3的盐酸和pH=11的氨水按等体积混合,反应后氨水过量,NH3•H2O+HCl═NH4Cl+H2O,酸碱中和反应放热,由于水的电离是吸热过程,温度升高,促进水的电离,平衡向着正向移动,生成的盐为强酸弱碱盐,水解促进水的电离,混合溶液中为氯化铵和一水合氨,电离大于水解,溶液呈碱性,所以反应后所得溶液中水的电离度为α1>α4;
故选C.
点评 本题主要考查了水的电离平衡的影响因素,注意Kw,温度升高可以促进水电离Kw增大,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 电镀时,待镀金属连接电源负极,发生氧化反应 | |
| B. | 工业上电解NaCl水溶液制备钠,电解熔融态Al2O3制备Al | |
| C. | 往往将铁闸门与直流电源的负极相连,这是牺牲阳极的阴极保护法 | |
| D. | 电解精炼铜时,电解液选用硫酸酸化的硫酸铜,精炼过程中,Cu2+浓度降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
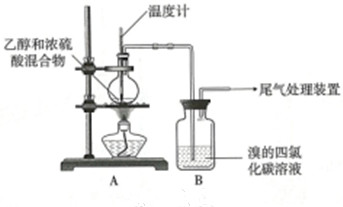
| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏的方法分离水和油的混合物 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量泥沙 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com