
【题目】浓度为2 mol·L-1的盐酸V L,欲使其浓度变为4 mol·L-1,以下列出的方法中可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 蒸发掉0.5V L水
D. 加入10 mol·L-1盐酸0.6V L,再将溶液稀释至2V L
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
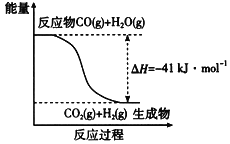
反应的热化学方程式为____________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJmol1,H—H键的键能是436.0 kJmol1,N—H键的键能是391.55 kJmol1,则![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ΔH=_____________________。
NH3(g) ΔH=_____________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g) ![]() CO2(g) ΔH1=393.5 kJmol1;②2H2(g)+O2(g)
CO2(g) ΔH1=393.5 kJmol1;②2H2(g)+O2(g) ![]() 2H2O(l) ΔH2=571.6 kJmol1;③2C2H2(g)+5O2(g)
2H2O(l) ΔH2=571.6 kJmol1;③2C2H2(g)+5O2(g) ![]() 4CO2(g)+2H2O(l)ΔH3=2599 kJmol1。298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
4CO2(g)+2H2O(l)ΔH3=2599 kJmol1。298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g) ![]() 2Al2O3(s) ΔH1;4Fe(s)+3O2(g)
2Al2O3(s) ΔH1;4Fe(s)+3O2(g) ![]() 2Fe2O3(s) ΔH2。下面关于ΔH1、ΔH2的比较正确的是________。
2Fe2O3(s) ΔH2。下面关于ΔH1、ΔH2的比较正确的是________。
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
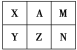
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O + 3e-=Fe(OH)3+5OH-
C. 放电时每转移3mol电子,正极有1mol K2FeO4被还原
D. 放电时正极附近溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为
A. 0.08molB. 0.06molC. 0.11molD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是( )
的叙述错误的是( )
A. 原子序数116B. 中子数177
C. 核外电子数116D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国稀土资源丰富。下列有关稀土元素![]() Sm与
Sm与![]() Sm的说法正确的是( )
Sm的说法正确的是( )
A. ![]() Sm与
Sm与![]() Sm的质量数相同
Sm的质量数相同
B. ![]() Sm与
Sm与![]() Sm互为同位素
Sm互为同位素
C. ![]() Sm与
Sm与![]() Sm是同一种核素
Sm是同一种核素
D. ![]() Sm与
Sm与![]() Sm核外电子数和中子数都为62
Sm核外电子数和中子数都为62
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A. 用氨水溶解氢氧化铜沉淀:Cu2++ 4NH3·H2O![]() [Cu(NH3)4]2+ + 4H2O
[Cu(NH3)4]2+ + 4H2O
B. NaHCO3溶液与NaAlO2溶液混合后产生白色沉淀:HCO3- + AlO2-+ H2O![]() Al(OH)3↓+ CO32-
Al(OH)3↓+ CO32-
C. 用稀硝酸清洗试管内壁的银镜:3Ag + 4H++ NO3-![]() 3Ag++ NO↑+ 2H2O
3Ag++ NO↑+ 2H2O
D. 用NaOH溶液除去镁粉中含有的杂质铝:2Al+ 2OH-+ 2H2O![]() 2AlO2-+ 3H2↑
2AlO2-+ 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是




甲 乙 丙 丁
A. 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B. 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C. 图丙表示反应CH4(g)+H2O (g)![]() CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com