
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Fe(OH)3胶体(NaCl溶液) | 水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.FeCl3可与Fe反应生成FeCl2;
B.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,通入二氧化碳生成氢氧化铝;
C.氯气不溶于饱和食盐水;
D.胶粒不能透过半透膜.
解答 解:A.FeCl3具有氧化性,与Fe反应生成FeCl2,可除杂,故A正确;
B.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,通入二氧化碳生成氢氧化铝,过滤、洗涤后应灼烧,故B错误;
C.氯气不溶于饱和食盐水,可用饱和食盐水除去氯化氢,故C正确;
D.胶粒不能透过半透膜,离子可以透过,可用渗析的方法分离,故D正确.
故选B.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=2 的H2C2O4 溶液与pH=12 的NaOH 溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | pH相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3molH2+2molN2 | B. | 4molNH3 | ||
| C. | 2molN2+6molH2 | D. | 1molNH3+0.5molN2+1.5molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应不需加热就能发生 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
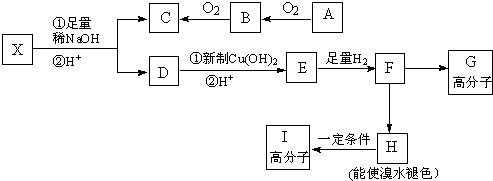
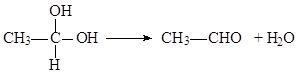
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性次序为c>b>a | |
| B. | 元素a和元素b、c均能形成共价化合物 | |
| C. | 元素d和元素b、c均能形成离子化合物 | |
| D. | 元素c最高和最低化合价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com