

 ,最外层7个电子,属于第ⅦA族元素,碘与氯是同族元素,所以它们位于元素周期表的第ⅦA族,同主族元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱,F、Cl、Br、I属于同主族元素,所以HI的稳定性比HCl弱,HI的还原性比HCl强,
,最外层7个电子,属于第ⅦA族元素,碘与氯是同族元素,所以它们位于元素周期表的第ⅦA族,同主族元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱,F、Cl、Br、I属于同主族元素,所以HI的稳定性比HCl弱,HI的还原性比HCl强,| 9.8×10-9 |
| (4×10-3)2 |
| ||
| ||


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| A、向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 |
| B、向水玻璃中滴加盐酸制备硅酸 |
| C、用加热法除去Ca(OH)2固体中混有的NH4Cl固体 |
| D、SO2通入酸性KMnO4溶液检验其漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 实验现象 | 结论 | |
| A | 某气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| B | 向浓度均为0.1mol?L-1NaCl和NaI混合溶液中,滴加几滴AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| C | 苯酚钠溶液中通入CO2气体 | 溶液变浑浊 | 碳酸酸性比苯酚强 |
| D | 分别向H2O和乙醇中加入少量Na | Na与水反应更加剧烈 | 水比乙醇易电离H+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 甲 | 乙 | 丙 |
| A | H2SO4 | NH4HCO3 | Ba(OH)2 |
| B | H2S | NaOH | SO2 |
| C | NH3 | NO2 | HNO3 |
| D | FeBr3 | Cl2 | Cu |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纯碱是强碱弱酸盐 | 用纯碱溶液可清洗油污 |
| B | 不锈钢是合金 | 不锈钢在潮湿环境中容易被腐蚀 |
| C | Fe2O3是碱性氧化物 | Fe2O3可用作红色油漆和涂料 |
| D | NO2是红棕色气体 | 常温下可用铜与浓硝酸制取NO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL 0.1mol?L-1氨水中逐滴加入0.1mol?L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示.下列说法正确的是( )
向20mL 0.1mol?L-1氨水中逐滴加入0.1mol?L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示.下列说法正确的是( )| A、在D点:c(NH4+)+c(NH3?H2O)>c(Cl-) | ||||
| B、在C点,有V1>10,且c(NH4+)c(Cl-)>c(OH-)=c(H+) | ||||
| C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||||
D、由B到C的过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| n(H2) |
| n(CO2) |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
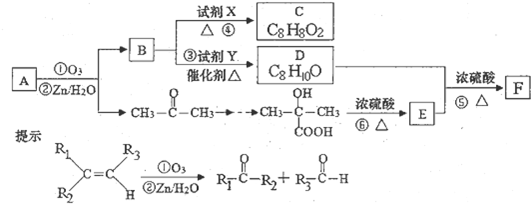
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com