解答:
解:(1)用醋酸羟基氧示踪含氧18水占到总水量的一半,酯也一样,说明酯化反应的历程可能是首先乙酸分子中含有碳氧双键打开发生加成反应,氧上连氢原子,碳上连乙氧基,生成
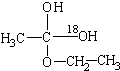
,连在同一碳上的两个羟基不稳定,会失水发生消去反应,失水有两种可能分别生成

,
故答案为:先加成反应生成

后消去失水,失水有两种可能分别生成

(2分)
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数只受温度影响,120℃时,取CH
3COOH与C
2H
5OH投料比为1:1,产率65%,则K=
| C(CH3COOC2H5)C(H2O) |
| C(CH3COOH)C(C2H5OH) |
=
=3.45,
故答案为:
=3.45;
①乙醇(俗名酒精)分子式为C
2H
6O,其相对分子质量为46,摩尔质量为46g/mol,无水乙醇3600元/吨,则每摩乙醇
×46=0.1656 元,
乙酸分子式为C
2H
4O
2,其相对分子质量为60,摩尔质量为60g/mol,冰醋酸2900元/吨,则每摩乙酸
×60=0.174 元,
故答案为:0.1656;0.174;
②乙酸乙酯的制备反应是可逆反应,每摩乙醇
×46=0.1656 元,每摩乙酸
×60=0.174 元,不断移走产物,使反应正向进行,补充反应物,从经济实用角度应选择乙醇过量,
故答案为:乙醇;
(3)液体乙酸乙醇沸点低,加入沸石(碎瓷片),可以通过孔隙凝聚蒸汽,使成为气泡浮出,防止暴沸,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加,
故答案为:防暴沸; B;
(4)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,
故答案为:先加入乙醇后加入硫酸,边振荡加滴加;
(5)通过分液漏斗中边滴加乙酸和乙醇混和液边加热蒸馏,可以不断增大乙酸和乙醇混和液的浓度,减小乙酸乙酯的浓度,有利于平衡向正反应方向移动,控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的保证乙醇量是乙酸量10倍以上,提高乙酸的转化率,
故答案为:保证乙醇量是乙酸量10倍以上,提高乙酸的转化率;
(6)

该反应为可逆反应,同时有副反应2C
2H
5OH
C
2H
5OC
2H
5+H
2O,所以反应物和生成物共存,蒸出的粗乙酸乙酯中主要有乙醚、乙酸、乙醇和水,饱和的Na
2CO
3溶液洗涤除去乙酸,碳酸钠呈碱性,乙酸呈酸性,如果乙酸全去除,则溶液呈碱性,用PH试纸即可检验,
故答案为:乙醚、乙酸、乙醇和水;pH试纸检验不显酸性;用饱和NaCl溶液洗涤除去残留的Na
2CO
3溶液,如用水洗,导致产率降低,乙醇与水互溶,用饱和CaCl
2溶液直接洗涤可除去少量的乙醇;减少乙酸乙酯溶解; 除去少量的乙醇;

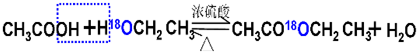

 ,连在同一碳上的两个羟基不稳定,会失水发生消去反应,失水有两种可能分别生成
,连在同一碳上的两个羟基不稳定,会失水发生消去反应,失水有两种可能分别生成 ,
, 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成 (2分)
(2分) 该反应为可逆反应,同时有副反应2C2H5OH
该反应为可逆反应,同时有副反应2C2H5OH

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案

