
| A.加强废电池回收,主要是为了回收电池中的石墨电极 |
| B.增加炼铁高炉的高度可以降低尾气中CO的含量 |
| C.把煤粉碎了再燃烧可以提高煤的燃烧效率 |
| D.升高温度可以使吸热反应速率加快,放热反应速率减慢 |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题

A.某酸式盐NaHY的水溶液显碱性,则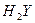 的电离方程式为H2Y H++HY- 的电离方程式为H2Y H++HY- |
| B.Na2CO3溶液中存在:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| C.在由水电离出的c(H+)=lxl0-14m01·L-1的溶液中,可以大量存在Na+、K+、NO3-、HCO3- |
| D.在常温下,向10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
| 加入盐酸体积V/Ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/ ℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
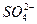 、
、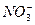 、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
| C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
| D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.③④ | C.①② | D.④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com