
某化学反应的反应物和产物如下:Al+NaNO3+H2O Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是______________。
(2)该反应的氧化产物是_______________。
(3)反应过程中转移5 mol e-,生成标准状况下N2的体积________L。
(4)配平该反应的化学方程式:
______Al+_____NaNO3+_____H2O==______Al(OH)3+______N2+______NaAlO2。
(1)NaNO3 (1分) (2)Al(OH)3、NaAlO2 (1分,漏选得0分)
(3)11.2 (2分) (4)10 6 6 4 3 6 (2分)
解析试题分析:(1)NaNO2中N元素的化合价降低,作氧化剂。
(2)还原剂(Al)生成的产物是氧化产物,Al(OH)3、NaAlO2中Al的化合价都是+3价,所以都是氧化产物。
(3)根据化合价升降配平:10Al+6NaNO3+6H2O=4Al(OH)3+3N2↑+6NaAlO2。根据关系式N2~10e-,若反应过程中转移5 mol e-,则生成标准状况下N2的体积为11.2 L。
(4)10Al+6NaNO3+6H2O=4Al(OH)3+3N2↑+6NaAlO2。
↑3×10 ↓5×2×3
考点:考查氧化还原反应。


科目:高中化学 来源: 题型:填空题
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示: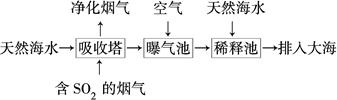
①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。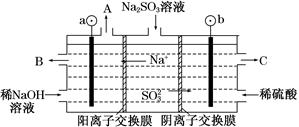
①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| III | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
| A.v(SO2)=v(SO3) | B.混合物的平均相对分子质量不变 |
| C.混合气体质量不变 | D.各组分的体积分数不变 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在氧化还原反应中,电子转移的表示方法通常用单线桥法和双线桥法。试分析这两种表示方法的特征,并填空。
(1)标单线桥(4分)
KIO3+6HI=KI+3I2+3H2O氧化产物与还原产物物质的量之比= 。
(2)配平化学方程式及标双线桥(5分)
Fe + HNO3(稀)= Fe(NO3)2+ NO↑+ H2O反应中,氧化剂与还原剂的物质的量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
肼(N2H4)是火箭发射常用的燃料。
(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子 时,可制得Cu2O的质量为__________。
(2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。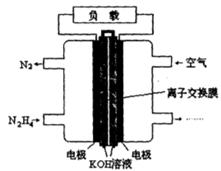
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是 ____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态 |
| C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大 |
| D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲 |
 CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______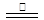 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;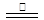 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。
(2)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl +N2若反应中NH3消耗6.8 g,则转移电子个数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com