
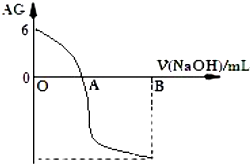
| A. | A 点时加入氢氧化钠溶液体积为 20 mL | |
| B. | OA 段溶液中:c(CH3COO-)>c(CH3COOH) | |
| C. | 室温时 0.01 mol/L的醋酸溶液 pH=4 | |
| D. | 若 B 点时加入 NaOH 溶液为 40 mL,所得溶液中:c(CH3COO-)+c(CH3COOH)=c(OH-) |
分析 A.A点AG为0,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1,则该点的c(OH-)=c(H+);
B.醋酸为弱电解质,开始阶段c(CH3COOH)>c(CH3COO-);
C.未加NaOH溶液时,该醋酸的AG=6,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=106、室温下c(OH-).c(H+)=10-14,所以该醋酸溶液中c(H+)=10-4,溶液的pH=-lgc(H+);
D.若 B 点时加入 NaOH 溶液为 40 mL,混合溶液中溶质为等物质的量浓度的NaOH和CH3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.A点AG为0,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1,则该点的c(OH-)=c(H+),溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则加入的NaOH体积应该小于20mL,故A错误;
B.醋酸为弱电解质,开始阶段如O点c(CH3COOH)>c(CH3COO-),故B错误;
C.未加NaOH溶液时,该醋酸的AG=6,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=106、室温下c(OH-).c(H+)=10-14,所以该醋酸溶液中c(H+)=10-4,溶液的pH=-lgc(H+)=-lg10-4=4,故C正确;
D.若 B 点时加入 NaOH 溶液为 40 mL,混合溶液中溶质为等物质的量浓度的NaOH和CH3COONa,溶液中存在电荷守恒和物料守恒,根据物料守恒:c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),联立可得:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+),故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断及识图能力,为高频考点,侧重考查学生自学能力、理解能力及综合知识运用能力,关键是对AG定义的理解,离子浓度比较中等量关系判断常涉及电荷守恒、微粒守恒、质子恒等式运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在25℃时,次氯酸的电离方程式及热效应可表示为:HClO(aq)=H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL1mol/L NaOH混合后的溶液,一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) | |
| C. | 将0.2mol/L NaClO 与0.1mol/L HCl等体积混合后的溶液,溶液显碱性,则存在:c(ClO-)>c(Cl-)>c(HClO)>c(OH-) | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Na+、Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| B | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2═CO32-+H2O |
| C | H+,Fe2+、SO42-、Cl- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl-、NO3- | 少量澄淸石灰水 | Al3++3OH-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y可形成的化合物在5种以上 | |
| B. | 工业上常常通过电解Z的熔融氧化物的方法来获得Z的单质 | |
| C. | 这五种元素形成的简单离子的半径由大到小为:W>Q>X>Y>Z | |
| D. | W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2SO3 | HSO3- | H2CO3 | HCO3- |
| PKa | 1.9 | 7.2 | 6.4 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
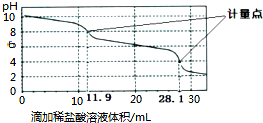
| A. | 上一计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-3mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合物中氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com