
��14�֣�ijʵ��С����0.50mol/L����������Һ��0.50mol/L������Һ���з�Ӧ�ȵIJⶨ��
������0.50mol/L����������Һ
��1����ʵ���д�ԼҪʹ��245mL NaOH��Һ��������Ҫ����NaOH����_________�ˡ�
��2�����ƹ����У�����Ҫ�IJ���������_____________________________________
�ⶨϡ�����ϡ����������Һ��Ӧ�ķ�Ӧ��ʵ��װ�����£�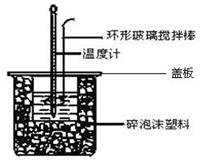
��3����ͼװ�����������β��������������___________________________________��
��4���ձ�����������ĭ���ϡ����ձ��ϼӸ�Ӳֽ���������__________________
��5����֪ϡ������ϡ����������Һ�����кͷ�Ӧ����1 molˮʱ���ų�57.3 KJ��������д���������������Ʒ����кͷ�Ӧ���Ȼ�ѧ����ʽ��__________________________________________����0.2 mol ϡ������Һ������ϡ����������Һ��Ӧ���ܷų�________kJ������
��6���ڲⶨ�кͷ�Ӧ�ķ�Ӧ�ȵ�ʵ���У�����������ȷ����
| A���ⶨ�кͷ�Ӧ�ķ�Ӧ��ʱ������к�֮��Ӧ��ȡ��ϵ�ﵽ������¶� |
| B���кͷ�Ӧ�������У�Ӧ���ٽ�NaOH��Һһ�ε���ʢ�����С�ձ��� |
| C���������������ش����������ƣ�Ũ�������ϡ���� |
| D���ڲⶨ�кͷ�Ӧ�ķ�Ӧ��ʵ���У�ÿ���һ�η�Ӧ���Ȳⶨ��������Ҫ�������¶� |
��1��5.0 �� ��2���ձ�������������ͷ�ιܡ�250mL����ƿ �� ��3�����裬ʹ��Һ��ֻ�� ����4�����¡����ȣ� ��5��H2SO4(aq) +2NaOH(aq) =NaSO4(aq)+2H2O(l) ��H=��114.6KJ.mol-1��22.9����6��A B D
���������������1����Ҫ����NaOH����m=nM=cVM=0.5mol/L��0.5L��40g/mol=5.0g���ʴ�Ϊ��5.0����2�����ƹ����У��������������ձ����ܽ⣬���������裬��ȴ���ò���������������ƿ�У����ý���ιܶ��ݣ��ʴ�Ϊ���ձ�������������ͷ�ιܡ�250mL����ƿ����3�����β���������������ǽ��裬ʹ��Һ��ֻ�� ����4���к��ȵ�ʵ��Ĺؼ��DZ��£���������ĭ���Ϻ�Ӳֽ��������Ƿ�ֹ�кͷ�Ӧʱ������ʧ���ʴ�Ϊ����ֹ�кͷ�Ӧʱ������ʧ����5��ϡǿ�ᡢϡǿ�Ӧ����1molҺ̬ˮʱ�ų�57.3kJ��������ϡ�������������ϡ��Һ��Ӧ���Ȼ�ѧ����ʽΪ��H2SO4(aq) +2NaOH(aq) =NaSO4(aq)+2H2O(l) ��H=��114.6KJ.mol-1���ʴ�Ϊ��H2SO4(aq) +2NaOH(aq) =NaSO4(aq)+2H2O(l) ��H=��114.6KJ.mol-1��
���㣺�к��ȵIJⶨ


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵���У�����ȷ����
| A���赥�ʳ���������̫���ܵ�غ��� |
| B��ʯ��ʯ�ڹ�ҵ�ϳ�������ˮ��Ͳ��� |
| C��̼��������ҽ���Ͽ���������θ����� |
| D���������������������µ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ijԪ�ص�ԭ�ӽṹʾ��ͼΪ �����й��ڸ�Ԫ�ص�˵���У��������
�����й��ڸ�Ԫ�ص�˵���У��������
| A�����������Ӵ�3����λ����� |
| B������һ�ֽ���Ԫ�� |
| C��������������10������ |
| D����ԭ�Ӻ�����13������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڻ�ѧ���������У���ȷ����
| A�����ӻ�������ܺ����ۼ� |
| B�����ۻ�������ܺ����Ӽ� |
| C�����ӻ�������ֻ�����Ӽ� |
| D�����ӻ�������һ�����н������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
10��)������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�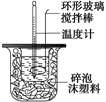
������Ͳ��ȡ50 mL 0.25 mol��L��1���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol��L��1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
��1��д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ(�к�����ֵΪ57.3 kJ��mol��1)��____________________________________________________________________��
��2������NaOH��Һ����ȷ������__________(������ѡ����ѡ��)��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________(������ѡ����ѡ��)��
A�����¶ȼ�С�Ľ���
B���ҿ�ӲֽƬ�ò���������
C����������ձ�
D���������¶ȼ��ϵĻ��β������������ؽ���
��4��ʵ���������±���
������д�±��еĿհף�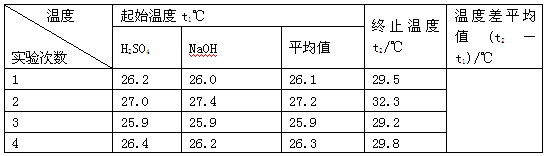
�ڽ�����Ϊ0.55 mol��L��1NaOH��Һ��0.25 mol��L��1������Һ���ܶȶ���1 g��cm��3���кͺ������ܵı�����c��4.18 J��g��1������1�������ϱ����ݼ����к��Ȧ�H��________(ȡС�����һλ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��15�֣�ijʵ��С����0.50 mol/L NaOH��Һ��0.50 mol/L������Һ�����к��ȵIJⶨ��
������0.50 mol/L NaOH��Һ
��1����ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH���� g��
��2�����ƹ�������Ҫ�õ��IJ����������ձ������������Ҫ�� �� ��
�ⶨ�к��ȵ�ʵ��װ������ͼ��ʾ��
��3����С�ձ�֮����������ĭ���ϵ������� ����ʵ��װ���Ͽ���ͼ��ȱ�ٵ�һ�ֲ������� ��
��4��ʹ�ò�ȫ�������װ�ý���ʵ�飬ȡ50mL 0.25mol��L H2SO4��Һ��50mL0.55 mol��L NaOH��Һ��С�ձ��н����кͷ�Ӧ��ʵ���������±���
������д�±��еĿհף�
| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | �� |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������ж����й��̵ķ������
| A��ˮ�����Է����ɸߴ����ʹ��� |
| B���������еĻ��ɢ��ʱ��Ϊ�������� |
| C�����ȷ�Ӧ�����У����ȷ�Ӧ�����Է����� |
| D�����ϴ���Ժ��˿��Ƶĺ����ɵĻ������еļ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������м��������������ʵ���Һ�������գ���Һ����400�棩���Եõ�ԭ���ʹ������
| A��AlCl3 | B��NaHCO3 | C��MgSO4 | D��KMnO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������У���Ͷ�����˽����������䡱���̣��������̲صķḻ��Դͨ���ܵ����͵�����������������ָ�ġ�����������Ҫ�ɷ���
| A��CH4 | B��CO | C��H2 | D��NH3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com