
分析 根据B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E可知,E为过氧化钠,则B元素为O元素、C元素为Na元素;
A原子的最外层上有4个电子且原子序数小于B(即氧元素),所以A为C元素;
D的L层电子数等于K、M两个电子层上的电子数之和,L层上有8个电子,K层上有2个电子,则M层上有6个电子,所以D元素为S元素,据此进行答题.
解答 解:B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E可知,E为过氧化钠,则B元素为O元素、C元素为Na元素;A原子的最外层上有4个电子且原子序数小于B(即氧元素),所以A为C元素;D的L层电子数等于K、M两个电子层上的电子数之和,L层上有8个电子,K层上有2个电子,则M层上有6个电子,所以D元素为S元素,
(1)根据分析可知,A为C元素,C为钠元素,
故答案为:C;钠;
(2)A元素为碳,B元素为氧,它们形成的化合物为二氧化碳,能与E(即过氧化钠)反应,化学方程式为:2CO2+2Na2O2═2Na2CO3+O2↑,
故答案为:2CO2+2Na2O2═2Na2CO3+O2↑;
(3)B为O、D为S,二者的氢化物分别为H2O、H2S,由于水分子中存在氢键,则水的沸点大于硫化氢,即:H2O>H2S;非金属性越强,对应氢化物的稳定性越强,非金属性大小为:O>S,则对应氢化物的稳定性:H2O>H2S,
故答案为:H2O>H2S;H2O>H2S;
(4)D为S元素,A元素为C,D的最高价氧化物对应的水化物为硫酸,浓硫酸与碳在加热条件下能够反应生成二氧化碳、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生灵活应用基础知识解决实际问题的能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
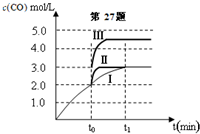 甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是LiOH | |
| B. | 离子的氧化能力最强的是Cs+ | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 单质的熔点随相对原子质量的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
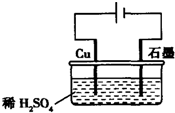
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| B. | 10 g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| C. | 200 ml1mol/LFe2(SO4 )3溶液中,Fe3+和SO42-离子数的总和是NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 所示.
所示. 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
 .
. .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两粒子的1s能级上电子的能量相同 | |
| B. | 两粒子的3p能级上的电子离核的距离相同 | |
| C. | 两粒子都达8电子稳定结构,化学性质相同 | |
| D. | 两粒子的电子发生跃迁时,产生的光谱不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com