
【题目】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:X,Y,Z,W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X,Y,W位置如图所示(副族省略),X,Y,Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( ) 
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y,W的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属。
(1)铝在元素周期表中的位置是_______________________________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为____________。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,你认为此说法________(填对或不对),认为不对的请说出原因____________________________并写出镁的冶炼的化学方程式 ________________________________________(认为对的此项可不作答)。
(3)铝与NaOH溶液反应的离子方程式为_____________________;
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①________,②冷却结晶,③过滤。在第①步操作中应注意的事项是__________________。
(5).加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,此操作应注意在___________ ,其原因是(结合化学方程式简要说明)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是

A. 通入N2的一极为负极
B. 通入H2的电极反应为:H2+2e-=2H+
C. 物质A是NH4Cl
D. 反应过程中左边区域溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
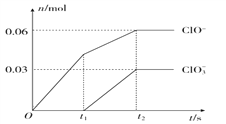
A. 反应中转移电子的物质的量是0.21mol
B. 一定有3. 36L氯气参加反应
C. 苛性钾溶液中KOH的质量是16.8g
D. ClO的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质仅用蒸馏水不能鉴别出的是( )
A.苯、酒精、硝基苯
B.食盐、烧碱、硝酸铵
C.氧化铜、二氧化锰、活性炭
D.蔗糖、硫酸铜粉末、碳酸钙粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯睛(C3H3N)和副产物丙烯醛(CH2=CHCHO)的热化学方程式如下:
① C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g)△H=-515kJ/mol
② C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是______;提高丙烯腈反应选择性的关键因素是_____.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D. 反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_________ ,理由是_______。进料氨、空气、丙烯的理论体积约为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)![]() C(s)+H2O(g) ΔH=+131.4kJ·mol-1
C(s)+H2O(g) ΔH=+131.4kJ·mol-1
C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com