
【题目】由铝粉与氧化铁组成的铝热剂,常用于焊接铁轨,试写出该反应的化学方程式:;在足量盐酸、氢氧化钠溶液中,分别加入ag该铝热剂充分反应,二者产生气体的体积比为(同温同压下).
【答案】2Al+Fe2O3![]() Al2O3+2Fe;1:1
Al2O3+2Fe;1:1
【解析】解:金属铝和氧化铁之间反应生成金属铁和氧化铝,该反应属于铝热反应,原理方程式为:2Al+Fe2O3 ![]() Al2O3+2Fe;铝与NaOH溶液反应生成偏铝酸钠和氢气,该离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,等质量铝投入足量盐酸和NaOH溶液中,因酸碱足量,生成氢气由Al决定,Al的质量相同,则生成氢气相同,其体积之比为1:1,所以答案是:2Al+Fe2O3
Al2O3+2Fe;铝与NaOH溶液反应生成偏铝酸钠和氢气,该离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,等质量铝投入足量盐酸和NaOH溶液中,因酸碱足量,生成氢气由Al决定,Al的质量相同,则生成氢气相同,其体积之比为1:1,所以答案是:2Al+Fe2O3 ![]() Al2O3+2Fe;1:1.
Al2O3+2Fe;1:1.
【考点精析】利用铝的化学性质对题目进行判断即可得到答案,需要熟知很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】随着卤素原子核电荷数的增加,下列递变规律正确的是
A. 单质的熔沸点逐渐降低B. 气态氢化物的稳定性逐渐降低
C. 卤素最高价含氧酸酸性逐渐增强D. 卤素单质的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠.这种制碱方法称为氨碱法,其主要步骤是:
①在含氨的饱和氯化钠溶液中通入CO2制得NaHCO3
②再将NaHCO3焙烧制得纯碱,CO2循环使用
③析出小苏打的母液中加入生石灰,NH3循环使用
我国著名化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方法称 , 副产品的一种用途为 .
(2)沉淀池中发生的化学反应方程式是 .
(3)写出上述流程中X物质的分子式 .
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 .
(5)设计实验检验产品碳酸钠中是否含有氯化钠
(6)侯德榜制碱的方法与氨碱法相比,其优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( ) 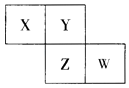
A.氧化物对应水化物酸性W比Z强
B.Y单质与Z的氢化物水溶液反应,有沉淀生成
C.X单质氧化性强于Y单质
D.简单离子的半径:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn还原SiCl4的反应如下:下列说法正确的是( )
SiCl4(g)+2Zn(l)Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)Si(s)+2ZnCl2(g)△H2 .
A.Zn(l)=Zn(g)△H= ![]() (△H1﹣△H2 )
(△H1﹣△H2 )
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,△H2变大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数:X>W>Z>Y.W原子的最外层没有p电子,X原子核外s电子数与p电子数之比为1:1,Y原子最外层s电子数之比为1:1,Z原子的p电子数比Y原子的多2个.
(1)四种元素原子半径从大到小的顺序为(用元素符号表示).
(2)请用“>”或“<”填空:
第一电离能 | 电负性 | 氢化物沸点 | 最高价氧化物对应水化物的碱性 |
WX | ZY | YZ | WX |
(3)写出X元素的单质与Z、Y所形成的化合物反应的化学方程式,并标出电子转移的方向和数目: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com