
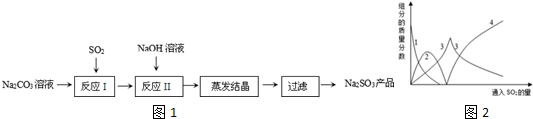
分析 碳酸钠溶液中通入二氧化硫依次发生的反应为Ⅰ:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+CO2,SO2+Na2SO3=2NaHSO3,反应Ⅱ是加入氢氧化钠溶液发生反应:NaHSO3+NaOH=Na2SO3+H2O(主要),SO2+2NaOH=Na2SO3+H2O(次要),得到亚硫酸钠溶液蒸发浓缩、冷却结晶过滤洗涤得到Na2SO3.
(1)依据反应过程和图象曲线变化可知,图象3表示的是亚硫酸钠,图象2表示的是碳酸氢钠;
(2)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠;
(3)①方法I称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,为硫酸钡沉淀质量,反应为:Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+BaCl2=2NaCl+BaSO4↓,结合硫酸钡物质的量,硫元素守恒计算;
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL,发生的反应为Na2SO3+I2+H2O=Na2SO4+2H I,计算亚硫酸钠质量得到质量分数;
③判断Na2SO3产品的等级,产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品;
解答 解;碳酸钠溶液中通入二氧化硫依次发生的反应为Ⅰ:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+CO2,SO2+Na2SO3=2NaHSO3,反应Ⅱ是加入氢氧化钠溶液发生反应:NaHSO3+NaOH=Na2SO3+H2O(主要),SO2+2NaOH=Na2SO3+H2O(次要),得到亚硫酸钠溶液蒸发浓缩、冷却结晶过滤洗涤得到Na2SO3.
(1)依据反应过程和图象曲线变化可知,图象3表示的是亚硫酸钠,线2表示的组分为NaHCO3,故
答案为:NaHCO3;
(2)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠,反应的化学方程式为:NaHSO3+NaOH=Na2SO3+H2O(主要); SO2+2NaOH=Na2SO3+H2O(次要),
故答案为:NaHSO3+NaOH=Na2SO3+H2O(主要); SO2+2NaOH=Na2SO3+H2O(次要);
(3)①方法I:Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+BaCl2=2NaCl+BaSO4↓
m(BaSO4)=4.660g,
n(BaSO4)=$\frac{4.660g}{233g/mol}$=0.020mol,
则经氧化后n(Na2SO4)=0.020mol,
m(Na2SO4)=0.020mol×142g/mol=2.840g,
根据差量法,原混合物中的Na2SO3:
n(Na2SO3)=$\frac{2.840g-2.570g}{16g/mol}$,
m(Na2SO3)=$\frac{2.840g-2.570g}{16g/mol}$×126 g/mol=2.12625g,
w(Na2SO3)=$\frac{2.1262g}{2.570g}$×100%≈82.73%.
如若不考虑杂质,则n(Na2SO3)=n(BaSO4)=0.020mol,
m(Na2SO3)=0.020mol×126 g/mol=2.520g,
w(Na2SO3)=$\frac{2.520g}{2.570g}$×100%≈98.05%,
故答案为:m(BaSO4)=4.660g,
n(BaSO4)=$\frac{4.660g}{233g/mol}$=0.020mol,
则经氧化后n(Na2SO4)=0.020mol,
m(Na2SO4)=0.020mol×142g/mol=2.840g,
根据差量法,原混合物中的Na2SO3:
n(Na2SO3)=$\frac{2.840g-2.570g}{16g/mol}$,
m(Na2SO3)=$\frac{2.840g-2.570g}{16g/mol}$×126 g/mol=2.12625g,
w(Na2SO3)=$\frac{2.1262g}{2.570g}$×100%≈82.73%.
如若不考虑杂质,则n(Na2SO3)=n(BaSO4)=0.020mol,
m(Na2SO3)=0.020mol×126 g/mol=2.520g,
w(Na2SO3)=$\frac{2.520g}{2.570g}$×100%≈98.05%,
②方法II:Na2SO3+I2+H2O=Na2SO4+2H I
n(Na2SO3)=n(I2)=20.00mL×10-3L/mL×0.1250mol/L=0.0025mol,
m(Na2SO3)=0.0025mol×126 g/mol×$\frac{100ml}{2500ml}$=1.260g,
w(Na2SO3)=$\frac{1.260g}{1.326g}$×100%≈95.02%,
故答案为:n(Na2SO3)=n(I2)=20.00mL×10-3L/mL×0.1250mol/L=0.0025mol,
m(Na2SO3)=0.0025mol×126 g/mol×$\frac{100ml}{2500ml}$=1.260g,
w(Na2SO3)=$\frac{1.260g}{1.326g}$×100%≈95.02%,
③国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品,方案I中Na2SO3的质量分数≥97.0%为优等品,方案II中的产品,Na2SO3的质量分数≥93.0%为一等品,但是方案I产品中含有的硫酸钠和碳酸钠等杂质,在方案I的测定中,硫酸钠和碳酸钠杂质对测定有干扰,而方案II是直接测定亚硫酸钠,可信度和精确度都要更高一些,
故答案为:方案I中的产品为优等品,方案II中的产品为一等品.但是方案I产品中含有的硫酸钠和碳酸钠等杂质,在方案I的测定中,硫酸钠和碳酸钠杂质对测定有干扰,而方案II是直接测定亚硫酸钠,可信度和精确度都要更高一些.
点评 本题考查了无机物制备流程、反应原理及其物质组成的实验测定和含量计算应用,题目难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、OH-、Cl- | D. | H+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
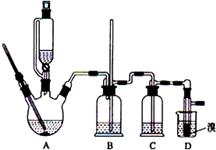 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 液溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红色发烟液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.12 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃烧热为-1559.9 kJ•mol-1,则乙烷燃烧的热化学方程式可表示为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com