
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:

(1)Cu与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写2种)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、 、过滤、冰水洗涤、低温烘干。
【答案】(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(2) 防止温度过高HNO3分解(或者挥发)(2分) ;搅拌、将固体废渣粉碎、适当提高硝酸的浓度(其它合理答案也对)(2分) (3) SiO2(2分) (4) 冷却结晶(2分)
【解析】
试题分析:(1)Cu与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(2)由于硝酸受热易分解,且硝酸是挥发性酸,所以酸溶时,反应温度不宜超过70℃的主要原因是防止温度过高HNO3分解(或者挥发);若保持反应温度为70℃,欲加快反应速率还可采取的措施有搅拌、将固体废渣粉碎、适当提高硝酸的浓度。
(3)由于二氧化硅不溶于酸,因此过滤后所得废渣的主要成分的化学式为SiO2。
(4)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、冰水洗涤、低温烘干。


科目:高中化学 来源: 题型:
【题目】为测定某补血剂样品【主要成分是硫酸亚铁晶体(FeSO4·7H2O)】中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用标准酸性KMnO4溶液滴定以测定铁元素的含量
⑴ 写出滴定反应的离子方程式 。
⑵ 下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。

⑶ 实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称)
方案二:将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

⑷ 步骤②中除用H2O2外还可以使用的物质是 。
⑸ 步骤②是否可以省略 ,理由是 。
⑹ 步骤④中一系列操作依次是:过滤、 、 、冷却、称量。
⑺ 假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物种类繁多的原因叙述不正确的是
A.碳原子性质活泼,容易形成化合物
B.碳原子间能以共价键形成碳链或碳环
C.碳原子之间能形成单键,也能形成双键或叁键
D.碳原子除了彼此间可以成键外,还可以与其他元素的原子成键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 可以用溴水鉴别丙烯和苯
B. 用无水硫酸铜可以检验酒精中是否含有水
C. 可以用氢氧化钠溶液鉴别乙醇和乙酸
D. 可以用烧灼的方法鉴别真丝布料和纯棉布料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入100mL 1molL﹣1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.3.2 g B. 2.4 g C.1.6 g D.0.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中,能大量共存的离子组是 :( )
A.Na、K+、SO42-、HCO3
B.Cu 2+、K+、SO42-、NO3-
C.NH4+、K+、Cl-、OH
D.Fe3+、K+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制480mL0.5mol·L-1的NaOH溶液,试回答下列问题。
(1)计算:需要NaOH固体的质量为___________。
(2)假定最终称量小烧杯的质量为____________(填“32.6g”或“32.61g”)。
在标尺(图)上画出游码位置(画“△”表示)。
![]()
(3)某学生实际配制的NaOH溶液的浓度为0.51mol·L-1,原因可能是________。
A.使用滤纸称量NaOH固体 |
B.容量瓶中原来存有少量水 |
C.溶解后的烧杯未经多次洗涤 |
D.用胶头滴管加水定容时俯视刻度 |
E.加水时超过刻度线,用胶头滴管吸出
F.转移溶液时未经冷却
(4)假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含100 mL的NaOH溶液,则该同学需取________mL盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
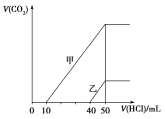
A.原NaOH溶液的物质的量浓度为0.5 mol·L-1
B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+===H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com