
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点K | 1266 | 1534 | 183 |

| 1 |
| 8 |
| 1 |
| 2 |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
 常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
 +CH3COOH→
+CH3COOH→ .聚合物可用于制备
.聚合物可用于制备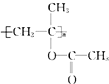
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++Cl2=2 Fe3++2 Cl- |
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 液反应生成盐;丙、戊可组成化合物M.
液反应生成盐;丙、戊可组成化合物M.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com