
| 92KJ |
| 3 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
| A、同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 |
| B、同主族元素随原子序数递增,单质氧化能力逐渐减弱 |
| C、同主族元素原子最外层电子数都相同 |
| D、同主族元素的原子半径,随原子序数增大而逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
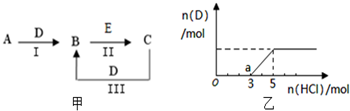 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中有NOx,主要是汽油不充分燃烧引起的 |
| B、发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品 |
| C、BaSO4难溶于水,医疗上可用做钡餐 |
| D、为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com