
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
分析 A.MnO4-为紫色;
B.使无色酚酞试液呈红色的溶液,显碱性;
C.pH=1的溶液,显酸性,离子之间发生氧化还原反应;
D.该组离子之间不反应.
解答 解:A.MnO4-为紫色,与无色不符,故A不选;
B.使无色酚酞试液呈红色的溶液,显碱性,不能大量存在Cu2+,故B不选;
C.pH=1的溶液,显酸性,H+、ClO-、S2-发生氧化还原反应,H+、ClO-、Cl-发生氧化还原反应,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
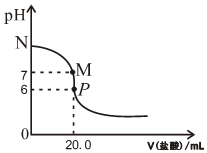 298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.
298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数小于NA个 | |
| C. | 2.3g金属钠变为钠离子失去0.1NA电子 | |
| D. | 2.24L CO2中含有的原子数为3×0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将铜粉与硫粉混合均匀加热以制取CuS | |
| B. | 将铜丝插入浓硫酸中并加热,反应后再加水以观察CuSO4溶液的颜色 | |
| C. | 向CuSO4溶液中加入过量的NaOH溶液,过滤洗涤并收集沉淀充分灼烧以制取CuO | |
| D. | 向淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2并加热,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
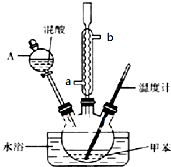 某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):
某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):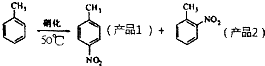
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 产品1 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 产品2 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com