

 和
和 

分析 根据结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;分子式相同,结构不同的化合物互称为同分异构体;质子数相同中子数不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;同种物质指组成和结构都相同的物质;然后对照概念分析.
解答 解:A.O2和O3是氧元素组成的结构不同的单质,互为同素异形体;
B.${\;}_{6}^{12}$C和${\;}_{6}^{13}$C 中子数不同,是碳元素的不同原子,互为同位素;
C.CH3CH2CH3 和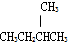 都属于烷烃;
都属于烷烃;
D. 和
和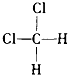 组成和结构都相同,为同一物质;
组成和结构都相同,为同一物质;
E.CH3CH2CH2CH3和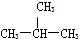 都是烃,分子式相同,结构不同,为同分异构体;
都是烃,分子式相同,结构不同,为同分异构体;
故答案为:B;A;CE;E;D.
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体、同一物质的区别,难度不大,注意把握概念的内涵与外延.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 地壳中含量最多的元素是氮元素 | B. | 最简单的有机物是甲烷 | ||
| C. | 相对分子质量最小的物质是水 | D. | 元素存在最硬的物质是金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向pH=12 的Ca(OH)2溶液中不断加水稀释 | |
| B. |  向CaCO3固体中逐滴加入稀盐酸至过量 | |
| C. |  在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. |  将等质量的金属镁片和锌片分别和足量的相同质量分数的稀硫酸混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸相似,NaN3水溶液中离子浓度大小为c(Na+)>c(N3-)>c(OH-)>c(H+)[ | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有碳元素和氢元素的化合物是烃类 | |
| B. | 相对分子质量相同的物质一定是同种物质 | |
| C. | 相对分子质量相差14的两种有机物,一定是属于同系物 | |
| D. | 分子式相同结构不同的有机物一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫铁矿高温下被空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3.设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
硫铁矿高温下被空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3.设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:
CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com