
分析 n(O2)=$\frac{17.92L}{22.4/mol}$=0.8mol,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,为水的质量,则n(H2O)=$\frac{14.4g}{18g/mol}$=0.8mol,可知n(H)=1.6mol,碱石灰增重1.76克,为二氧化碳的质量,则n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,发生CO+CuO$\frac{\underline{\;加热\;}}{\;}$Cu+CO2,由方程式可知固体质量减少的量为氧原子的质量,等于CO的物质的量,则n(CO)=$\frac{6.4g}{16g/mol}$=0.4mol,结合氧原子守恒可确定有机物分子式,结合性质可确定有机物的结构简式.
解答 解:(1)n(O2)=$\frac{17.92L}{22.4/mol}$=0.8mol,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,为水的质量,则n(H2O)=$\frac{14.4g}{18g/mol}$=0.8mol,可知n(H)=1.6mol,碱石灰增重1.76克,为二氧化碳的质量,则n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,发生CO+CuO$\frac{\underline{\;加热\;}}{\;}$Cu+CO2,由方程式可知固体质量减少的量为氧原子的质量,等于CO的物质的量,则n(CO)=$\frac{6.4g}{16g/mol}$=0.4mol,
由氧原子守恒可知0.2mol有机物中n(O)=0.4mol×2+0.4mol+0.8mol-2×0.8mol=0.4mol,
则有机物中N(C)=$\frac{0.4mol+0.4mol}{0.2mol}$=4,N(H)=$\frac{0.8mol×2}{0.2mol}$=8,N(O)=$\frac{0.4mol}{0.2mol}$=2,所以分子式为C4H8O2,
答:有机化合物A的分子式C4H8O2;
(2)若有机化合物A能与碳酸氢钠溶液反成产生气体,则含有羧基,应为C3H7COOH,对应的有机物可能为CH3CH2CH2COOH或CH3CH(CH3)COOH.
答:A所有可能的结构简式为CH3CH2CH2COOH或CH3CH(CH3)COOH.
点评 本题考查有机物的推断,侧重于学生计算能力和分析能力的考查,题目难度中等,注意把握有机物的燃烧规律,结合有机物的性质进行推断.


科目:高中化学 来源: 题型:选择题
| A. | 质量数是1 | B. | 质子数是2 | C. | 中子数是2 | D. | 电子数是1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3L | B. | 2L | C. | 1L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
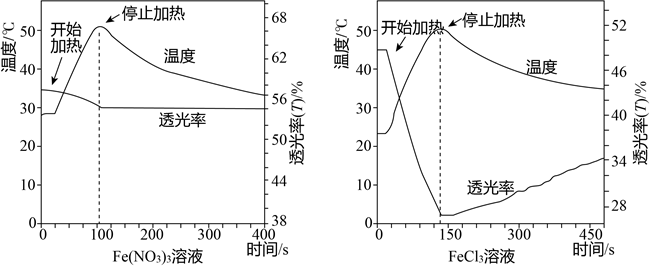
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 2.8g | C. | 5.62g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com