

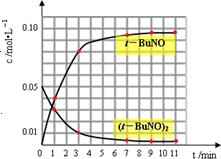
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
| ||
| △t |
| ||
| 10min |
 2(t-BuNO)
2(t-BuNO)| c2(t-BuNO) |
| c(t-BuNO) |
| (0.6mol/L)2 |
| 0.2mol/L |
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、铜-锌-稀硫酸组成的原电池中,锌为正极 |
| B、铜-锌-稀硫酸组成的原电池中,电解质溶液的质量逐渐减轻 |
| C、用石墨电极电解CuCl2溶液时,阳极上Cu2+放电而析出金属铜 |
| D、用石墨电极电解CuCl2溶液时,电解质溶液的浓度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | |
| 不属于该类别的物质 | Na2CO3 |
| 分类标准 | 能导电的物质 | 电解质 | 强电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:
W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 |
| B、厨房中燃气泄漏,立即打开抽油烟机排气 |
| C、硝酸是重要的工业原料,可用于制造炸药 |
| D、高纯硅可用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤液b的pH=7 |
| B、②中颜色变化说明Mg(OH)2转化为Fe(OH)3 |
| C、实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小 |
| D、浊液a中存在沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com