
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________________,K值大小与温度的关系:温度升高,K值__________________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
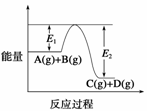
(2)在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850 ℃时发生如下反应:
CO(g)+H2O(g)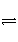
 CO2(g)+H2(g)+Q(Q>0)
CO2(g)+H2(g)+Q(Q>0)
CO和H2O浓度变化如图所示: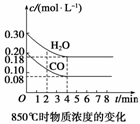
则0~4 min间平均反应速率v(CO)=________mol·L-1·min-1。
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下所示。
t℃时物质浓度(mol·L-1)的变化
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3~4 min之间反应处于________状态;c1数值________0.08 mol·L-1(填“大于”、“小于”或“等于”)。
②反应在4~5 min间,平衡向逆方向移动,可能的原因是________(单选)。表中5~6 min之间数值发生变化,可能的原因是________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增大氢气浓度
1)可逆反应进行的程度越大 可能增大也可能减小 (2)0.03 (3)①平衡 大于 ②d a
解析 (1)根据平衡常数的定义可以做出回答。
(2)v(CO)=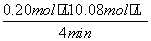 =0.03 mol·L-1·min-1。
=0.03 mol·L-1·min-1。
(3)由题设表格中数据分析3~4 min 时各物质的浓度没变,说明处于平衡状态;根据题给表中数据0~2 min CO的浓度每分钟减少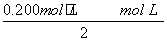 =0.031 mol·L-1,根据速率与浓度的关系,随浓度的减小,CO的变化速率减小,所以第3 min时,[CO]>0.138 mol·L-1-0.031 mol·L-1>0.08 mol·L-1。4~5 min间平衡逆向移动,根据平衡移动的影响因素和题给条件分析应该是加入了生成物,即d;5~6 min之间c(CO)减小,而c(H2O)和c(CO2)增大,说明一定是增加水蒸气,使平衡向正反应方向移动了。
=0.031 mol·L-1,根据速率与浓度的关系,随浓度的减小,CO的变化速率减小,所以第3 min时,[CO]>0.138 mol·L-1-0.031 mol·L-1>0.08 mol·L-1。4~5 min间平衡逆向移动,根据平衡移动的影响因素和题给条件分析应该是加入了生成物,即d;5~6 min之间c(CO)减小,而c(H2O)和c(CO2)增大,说明一定是增加水蒸气,使平衡向正反应方向移动了。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐增强
D.LiOH、NaOH、KOH的碱性依次逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元索,X、Y处于同一周期,X、Z的最低价离子分别为x2-和z-,Y+ 和z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B、单质活泼性: X>Y>Z
C. 原子序数: X>Y>Z D、离子半径: X2—>Y+>Z—
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)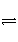
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”),原因是______________________________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?____________,原因是
________________________________________________________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体通入BaCl2溶液无沉淀生成。若再分别通入以下四种气体:①Cl2 ②H2S ③NH3 ④NO2则均有沉淀生成。其中产生的沉淀的化学成分相同的是( )
A.③和④ B.①和② C.①③④ D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
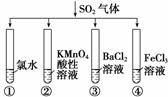
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中无明显现象
D.试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
人们在研究金星大气成分时发现金星大气中有一种称为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列有关COS的推测不正确的是 ( )
A.COS分子是含有极性键的极性分子
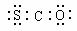 B.COS的电子式为:
B.COS的电子式为:
C.COS的分子中所有原子满足8电子稳定结构 D.COS分子中三个原子处于同一直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com