
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊A |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 35 | 数据模糊B |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊C |
| 7 | 0.10 | 丝 | 1.0 | 50 | 数据模糊D | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 未测数据 | 40 |
分析 (1)实验4和5、实验1和2均只有接触面积不同;
(2)上述实验中温度、浓度、接触面积不同;
(3)前6组实验中温度差分别为14、15、16、15、15、15,反应中能量变化与参加反应的量有关;
(4)温度越高,接触面积越大,浓度越大,反应速率越快.
解答 解:(1)实验4和5表明,固体反应物的表面积对反应速率有影响,接触面积越大反应速率越快,能表明同一规律的实验还有1和2,
故答案为:固体反应物的表面积;接触面积越大;1和2;
(2)本实验中影响反应速率的其他因素还有温度和硫酸的浓度,故答案为:温度和硫酸的浓度;
(3)前6组实验中温度差分别为14、15、16、15、15、15,则实验中的所有反应,反应前后溶液的温度变化值相近约为15℃,推测未测数据可能为30+15=45℃,分析△t相近的原因为金属的质量和硫酸的用量均相等,且与硫酸反应完全,能量的变化相同,
故答案为:15;45;金属的质量和硫酸的用量均相等,且与硫酸反应完全,能量的变化相同;
(4)实验3、4只有浓度不变,浓度大的反应速率快,可知A为250;实验4、5接触面积不同,接触面积大的反应速率快,结合1、2中时间为10倍关系,则B为25;实验6、7只有温度不同,温度高反应速率快,则C大于50,应为125,则经仔细辨认,数据模糊为25、35、125、250,则数据模糊A、B、C分别为250、25、125,
故答案为:250、25、125.
点评 本题考查反应速率的探究,为高频考点,把握表格中数据、温度、浓度对反应速率的影响为解答的关键,侧重分析与实验能力的考查,注意控制变量法应用,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4]2+离子中,Cu2+提供孤电子对,NH3提供空轨道
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(l)=H2(g)+ O2(g);△H= +242kJ·mol-1
O2(g);△H= +242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);△H= -484kJ·mol-1
C. H2(g)+ O2(g)=H2O(g);△H= +242kJ·mol-1
O2(g)=H2O(g);△H= +242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);△H= -484kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
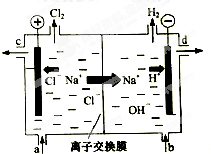 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加入少量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 少量CO2通入苯酚钠溶液:2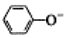 +CO2+H2O→2 +CO2+H2O→2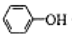 +CO32- +CO32- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液至溶液呈中性:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8g Na2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2LSO3中含有的分子数目为0.5 NA | |
| C. | 常温常压下,46gNO2与 N2O4的混合气体含有的氮原子数目无法计算 | |
| D. | 0.1 mo1•L-1 MgC12溶液中含有的Mg2+数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com