
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
| △c |
| △t |
| 0.4mol/L |
| 2s |
| 0.4mol/L |
| 1mol/L |
| 0.2mol/L |
| 0.5mol/L |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
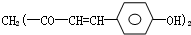 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )| A、3mol,3mol |
| B、1mol,5mol |
| C、6mol,8mol |
| D、2mol,10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
| A、CH3OH的起始浓度为1.64 mol/L |
| B、此时逆反应速率小于正反应速率 |
| C、平衡时,CH3OH的浓度为0.04 mol/L |
| D、平衡时,CH3OH的转化率小于90% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 5 |
| A、50% | B、37.5% |
| C、25% | D、12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏、煤的气化、海水提溴过程都包含化学变化 |
| B、地沟油经处理后可作为汽车燃油,故地沟油成分是液态烃 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、乙烯和苯都能使溴水褪色,且褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com