
道尔顿的原子学说在化学发展史中曾经起了很大作用。他的学说中,包含有下述三个论点:
①原子是不能再分的粒子;
②同种元素的原子的各种性质和质量都相同;
③原子是微小的实心球体。从现代的观点看,
你认为这三个论点中,不确切的是


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某无色透明混合气体可能含有H2,CO,CO2,HCl,NH3,H2O(气)中的两种或多种.当混合气体依次通过
①澄清石灰水(无浑浊现象), ②氢氧化钡溶液(有浑浊现象); ③浓H2SO4(无现象);
④灼热氧化铜(变红), ⑤无水硫酸铜(变蓝).
则该气体成分的正确判断是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
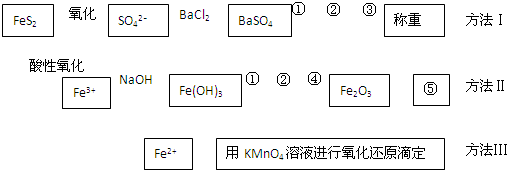
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com