
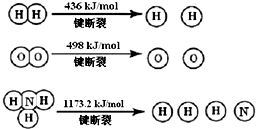
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量有关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 此反应构成的原电池中,正极可以是碳棒、铜或锌 |
分析 A、化学反应的实质是旧键断裂,吸收能量,新键形成放出能量;
B、确定反应的焓变与化学方程式中的系数有关,与物质的用量无关;
C、自发进行的氧化还原反应可以设计成原电池,实现化学能转化为电能;
D、原电池原理可知活泼金属做原电池的负极发生氧化反应,该氧化还原反应中,应为铁失电子发生氧化反应.
解答 解:A、该反应为放热反应,反应物旧键断裂吸收能量,生成物形成新键放出能量,反应物的总键能小于生成物的总键能,是化学反应中能量变化的主要原因,故A正确;
B、确定反应的焓变与化学方程式中的系数有关,系数不变焓变数值不同,与物质的用量无关,反应放出的热量与用量有关,故B错误;
C、反应是自发进行的氧化还原反应,可以设计成原电池把化学能转化为电能,故C正确;
D、铁在反应中失电子发生氧化反应,原电池中作为负极,负极发生的反应是:Fe-2e=Fe2+,若正极为锌,则锌做负极失电子发生氧化反应,不能符合此氧化还原反应,正极可以是碳棒、铜,但不能为锌,故D错误;
故选BD.
点评 本题考查了化学反应能量变化的实质分析,反应焓变的含义和能量变化,主要是原电池原理的分析应用,题目较简单.


科目:高中化学 来源: 题型:解答题
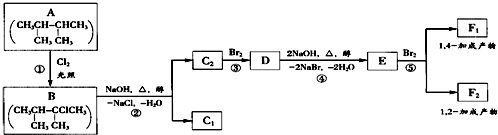
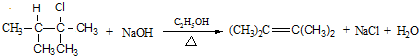 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+2OH-=2H2O+2e- | B. | O2+4H++4e-=2H2O | ||
| C. | H2-2e-=2H+ | D. | O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4 | B. | FeCl2 | C. | AlCl3 | D. | NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷<异戊烷<新戊烷 | B. | 正戊烷>新戊烷>异戊烷 | ||
| C. | 邻二甲苯>间二甲苯>对二甲苯 | D. | 邻二甲苯<间二甲苯<对二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12有2种同分异构体 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得物质共有6种 | |
| C. | C8H10中只有三种属于芳香烃的同分异构体 | |
| D. | CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,先得到的少量液体可能会与器壁等接触而含杂质较多,可以弃掉 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏,为了更好的控制温度,用水浴加热比直接加热要好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com