
分析 (1)根据氯气和水反应的方程式确定含氯元素的粒子;
(2)氯气的颜色是黄绿色,根据氯水的颜色判断是否含有氯气;
(3)含有酚酞的红色NaOH溶液,利用氯水中含有盐酸和次氯酸来分析;
(4)对褪色的溶液,若再加碱,恢复红色,则褪色是酸碱中和的原因;若再加碱,仍为无色,则是HClO的强氧化性的原因使溶液红色褪去.
解答 解:(1)因氯气和水反应生成盐酸和次氯酸,盐酸为强酸完全电离,次氯酸为弱酸部分电离,所以饱和氯水中含有氯元素的粒子为Cl2、Cl-、HClO、ClO-,
故答案为:Cl2、Cl-、HClO、ClO-;
(2)因氯气为黄绿色气体,氯水为浅黄绿色,则氯水显浅黄绿色能证明氯水中含有Cl2,
故答案为:氯水显浅黄绿色;
(3)因碱遇酚酞变红,氯水中有盐酸,盐酸与碱发生中和反应,HCl中和了NaOH,则红色褪去,氯水中还有次氯酸,次氯酸具有强氧化性,HClO氧化了酚酞而使红色褪色,
故答案为:HCl中和了NaOH;HClO氧化了酚酞;
(4)对褪色的溶液,取试管内的无色溶液3mL盛于另一支洁净的试管中,再向试管内滴加2滴NaOH溶液振荡后发现恢复红色,则证明溶液红色褪去的原因是①而不是②;
若再加碱,仍为无色,则证明溶液红色褪去的原因是②而不是①.
故答案为:取适量无色溶液于洁净的试管中,加2滴氢氧化钠溶液,振荡,观察现象,若溶液呈现红色,则证明溶液红色褪去的原因是①不是②;若溶液仍为无色,则证明溶液红色褪去的原因是②不是①.
点评 本题为实验探究习题,同时考查氯水的成分、氯气、次氯酸的性质,明确溶液显红色和红色褪去的可能性是解答本题的关键,难度不大,注重了基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是联系宏观和微观的物理量 | |
| B. | Na的摩尔质量为23g/mol | |
| C. | 非标准状况下气体摩尔体积不可能为22.4 L | |
| D. | 1mol氢的质量为2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量CH3COONH4固体,溶液的pH增大 | |
| B. | 一定温度下,将pH=a的氨水溶液稀释10倍后,其pH=b,则a=b+1 | |
| C. | 浓度均为0.1mol•L-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1mol•L-1 | |
| D. | 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
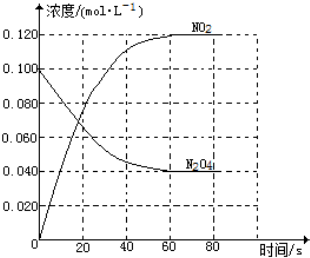 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
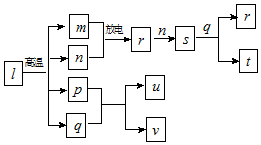 短周期主族元素X、Y、Z、W的原子序数依次增大.在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0.01mol•L-1v溶液的pH均为2.
短周期主族元素X、Y、Z、W的原子序数依次增大.在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0.01mol•L-1v溶液的pH均为2.| A. | 原子半径:r(X)<r(Z)<r(Y) | |
| B. | 简单氢化物的稳定性:Y>Z>W | |
| C. | W的氧化物的水化物的酸性一定比Y的强 | |
| D. | X、Y、Z三种元素形成的化合物只能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
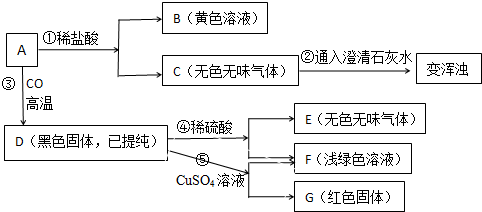
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可使石蕊试液褪色 | |
| B. | 通入BaCl2溶液中,生成白色沉淀 | |
| C. | SO2通入氢氧化钠与酚酞的混合溶液中红色变浅直至褪去 | |
| D. | 等物质的量的Cl2和SO2通入品红溶液中,品红溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA | |
| B. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA | |
| C. | 5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA | |
| D. | 在0.1mol蓝矾晶体和1L 0.1moL•L-1AlCl3溶液中,金属阳离子总数均小于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com