
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴、溴苯均易溶于苯;
B.甲醛溶于水,甲烷不能;
C.二者均与NaOH溶液反应;
D.氯化钠可透过半透膜,而淀粉胶体不能.
解答 解:A.溴、溴苯均易溶于苯,不能除杂,应选NaOH溶液、分液,故A错误;
B.甲醛溶于水,甲烷不能,则选择水洗气后,再选浓硫酸干燥可分离,故B正确;
C.二者均与NaOH溶液反应,不能除杂,应选饱和碳酸钠溶液、分液,故C错误;
D.氯化钠可透过半透膜,而淀粉胶体不能,应选渗析法分离,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及应用,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
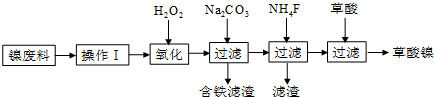
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2、CO2、H2O、HBr | B. | CO2、O2、H2S、HCl | ||
| C. | Na2O2、S8、CO2、H2O | D. | CO2、H2S、H2O、HI |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
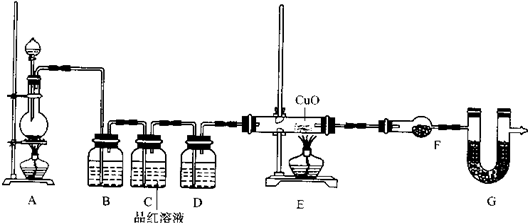
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Cl--2e-=Cl2↑ | B. | Cu2++2e-=Cu | ||
| C. | 4OH--4e-=2H2O+O2↑ | D. | 2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 非金属元素形成的单质中,一定有非极性共价键 | |
| C. | 两种元素组成的分子中一定只有极性键 | |
| D. | 均由非金属元素形成的化合物不可能是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
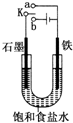 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com