

 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$ (R,R′代表烃基)
(R,R′代表烃基)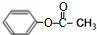 .
. .
. 分析 A水解得到乙酸与B,则A属于酯,结合W的结构可知,A为醋酸苯酚酯,即A为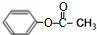 ,故W中-R是-CH3,B为
,故W中-R是-CH3,B为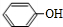 .苯与氢气发生加成反应生成D为
.苯与氢气发生加成反应生成D为 ,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为
,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为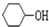 ,苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为
,苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为 ,F为
,F为 ,据此解答.
,据此解答.
解答 解:A水解得到乙酸与B,则A属于酯,结合W的结构可知,A为醋酸苯酚酯,即A为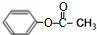 ,故W中-R是-CH3,B为
,故W中-R是-CH3,B为 .苯与氢气发生加成反应生成D为
.苯与氢气发生加成反应生成D为 ,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为
,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为 ,苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为
,苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为 ,F为
,F为 ,
,
(1)由上述分析可知,W中-R是-CH3,故答案为:-CH3;
(2)由上述分析可知,A的结构简式是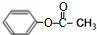 ,故答案为:
,故答案为: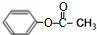 ;
;
(3)A生成B和CH3COOH的反应发生酯的水解反应,故答案为:取代反应(水解反应);
(4)D→X过程: 与氯气发生取代反应生成
与氯气发生取代反应生成 ,再在氢氧化钠水溶液、加热条件下发生水解反应生成
,再在氢氧化钠水溶液、加热条件下发生水解反应生成 ,引入的官能团分别是氯原子、羟基,故答案为:氯原子、羟基;
,引入的官能团分别是氯原子、羟基,故答案为:氯原子、羟基;
(5)由Y生成四溴双酚F的反应方程式是: ,
,
故答案为: .
.
点评 本题考查有机物的推断,充分利用转化关系中有机物的结构、反应条件采取正、逆推法相结合推断,关键是理解过氧化物条件下发生的反应,较好的考查形成分析推理能力、知识迁移运用能力,难度中等.


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| I | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| II |  | 液面上方出现白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有碳酸根离子 | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,一定有硫酸根离子 | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有氨根离子 | |
| D. | 为检验酸性溶液中的氯离子和硫酸根离子,应先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com