
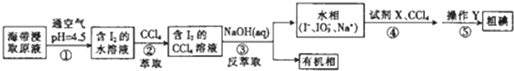
| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |
分析 海带浸取原液在pH=4.5时通入空气发生氧化还原反应生成碘,加入四氯化碳萃取得到含碘的四氯化碳溶液,然后加入氢氧化钠溶液进行反萃取,得到有机相和水相,水相中含有碘离子、碘酸根离子和钠离子,然后加入酸酸化,碘离子和碘酸根离子发生氧化还原反应可生成碘,加入四氯化碳萃取,蒸馏可得到粗碘,以此解答该题.
解答 解:A.萃取是根据物质的溶解性进行分离,没有涉及化学变化,为物理过程,故A正确;
B.步骤③为碘与氢氧化钠的反应,生成碘离子和碘酸根离子,只有碘元素化合价发生变化,碘既是氧化剂也是还原剂,故B错误;
C.酸性条件下,碘离子和碘酸根离子发生氧化还原反应可生成碘,可加入稀硫酸,故C正确;
D.步骤⑤用于分离碘的四氯化碳溶液和水相,分离碘和四氯化碳,则涉及的主要操作Y为分液和蒸馏,故D正确.
故选B.
点评 本题碘的制备实验方案为载体,考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,流程分析应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,为i个贫困的,注意把握物质的性质以及实验的合理性和可行性的评价,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2S | C. | (NH4)2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
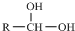 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$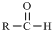 请根据如图回答:
请根据如图回答: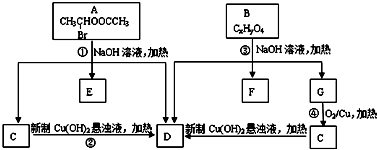
 .
. ;
; .
.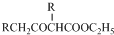 +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)>NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
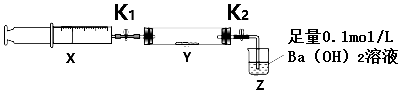
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | ①淡黄色固体变为白色粉末 | ②反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | ③Z中液体出现倒吸 | ④不用解释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com