
下列操作对应的现象及解释正确的是
编号 操 作 现 象 解 释
A FeI2溶液中滴加过量氯水 溶液变黄 氯水氧化I-成碘单质,碘水呈黄色:
2I-+Cl2=I2+2Cl-
B 苯酚钠溶液中通入少量CO2 出现白色浑浊 苯酚酸性弱于碳酸,反应生成苯酚:
2C6H5O-+CO2+H2O=2C6H5OH+CO32-
C Ca(HCO3)2溶液中滴加过量NaOH溶液 出现白色沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O
D 含有等浓度的Mg2+和Cu2+的废水液中逐滴加入少量NaOH溶液调节溶液pH=7 溶液中先出现蓝色沉淀 Ksp[Cu(OH)2]< Ksp[Mg(OH)2],因此Cu2+先沉淀;Cu2++2OH-=Cu(OH)2↓
D
【解析】
试题分析:A.Fe2+、I-都有还原性,由于氯水过量,所以发生反应2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-.错误。B.酸性:H2CO3> C6H5OH> HCO3-。所以向苯酚钠溶液中通入少量CO2,发生反应C6H5O-+CO2+H2O=C6H5OH+HCO3-。错误。C.酸式盐与碱发生反应时应该以不足量的物质为标准,向Ca(HCO3)2溶液中滴加过量NaOH溶液,发生反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O.错误。D.因为Ksp[Cu(OH)2]< Ksp[Mg(OH)2],所以向含有等浓度的Mg2+和Cu2+的废水液中逐滴加入少量NaOH溶液调节溶液pH=7 Cu2+先沉淀,Cu2++2OH-=Cu(OH)2↓,然后再发生:Mg2++2OH-=Mg(OH)2↓。正确。
考点:考查氯水、二氧化碳的化学性质及酸式盐与碱的反应及沉淀反应的先后顺序的知识。


科目:高中化学 来源: 题型:
 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
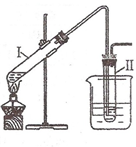 (2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.
(2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.| △ |
| △ |
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 1 | 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. |
液体分层,上层可能含有NaOH及NaBr. 液体分层,上层可能含有NaOH及NaBr. |
| 2 | 取上层清夜于小试管中,加入过量的稀硝酸酸化. 取上层清夜于小试管中,加入过量的稀硝酸酸化. |
无明显现象. 无明显现象. |
| 3 | 取少许酸化后的溶液用pH试纸检验. 取少许酸化后的溶液用pH试纸检验. |
pH试纸呈红色,溶液呈酸性. pH试纸呈红色,溶液呈酸性. |
| 4 | 向上述酸化的溶液中滴加AgNO3溶液. 向上述酸化的溶液中滴加AgNO3溶液. |
有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
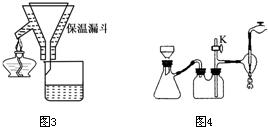 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com