
| 弱酸 | HCOOH | HCN | H2CO3 | HNO2 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=4.0×10-4 |
| A. | 甲酸和碳酸的分子式中均含两个氢原子,均属于二元酸 | |
| B. | 向NaCN溶液中通入少量的CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HNO2消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
分析 A.按电水溶液中离出的氢离子的个数,酸可以分为一元酸、二元酸和多元酸;
B.向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳;
C.等pH的HCOOH和HCN,酸的电离平衡常数越大,该酸的浓度越小,等体积等pH的不同酸消耗NaOH的物质的量与酸的物质的量成正比;
D.等体积、等浓度的HCOONa和NaCN两溶液中阴离子水解程度不同,水的电离程度不同,结合电荷守恒分析判断.
解答 解:A.按电离出的氢离子的个数,酸可以分为一元酸、二元酸和多元酸,H2CO3、H2SO4分子电离出2个氢离子为二元酸,HCOOH只能电离出一个氢离子,为一元酸,故A错误;
B.向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为:CN-+H2O+CO2═HCN+HCO3-,故B错误;
C.酸性HNO2 >HCOOH,等pH、等体积的HCOOH和HNO2,HCOOH浓度大,n(HNO2)<n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HNO2消耗NaOH的量前者大于后者,故C正确;
D.HCOO-水解程度小于CN-,则HCOONa溶液中氢氧根离子浓度小于NaCN溶液中氢氧根离子浓度,溶液中存在电荷守恒:c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),钠离子浓度相同,HCOONa溶液中氢离子浓度大于NaCN溶液中氢离子浓度,则HCOONa溶液中离子总浓度大于NaCN溶液中离子总浓度,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确酸的电离平衡常数与酸的强弱、酸根离子水解程度大小之间的关系是解本题关键,再结合物料守恒、物质的性质等知识点来分析解答,注意采用逆向思维的方法确定盐溶液浓度.


科目:高中化学 来源: 题型:选择题
| A. | 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA | |
| B. | ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同 | |
| C. | ①、②都达到平衡时,体系内混合气体的组成百分比相同 | |
| D. | 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图实验可制取少量氨气 | |
| B. |  如图实验中逐滴滴加稀盐酸时,试管中开始无气泡 | |
| C. | 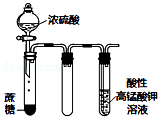 如图实验中酸性KMnO4溶液中有大量气泡出现,酸性KMnO4溶液褪色 | |
| D. | 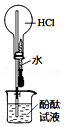 如图实验可观察到红色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸 | |
| B. | 四苯基乙烯( )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| C. | lmol  分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种违章的物质的量分别是3mol、4mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种违章的物质的量分别是3mol、4mol、1mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中的相邻原子都以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 干冰升华时,分子内共价键会发生断裂 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子个数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>B>A | |
| B. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 | |
| C. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| D. | B的单质比A的单质更易与氢气化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XYZ2 | B. | X2YZ3 | C. | X2Y2Z3 | D. | XYZ3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com