
【题目】脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
③H2O(g)![]() H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1
写出常温下,NH3还原NO反应的热化学方程式__。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为__。
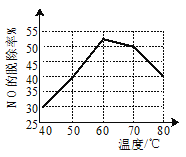
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示。图中,40~60℃NO脱除率上升可能的原因为__;60~80℃NO脱除率下降可能的原因为__。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为![]() +
+![]() +2OH-
+2OH-![]()
![]() +2
+2![]() +H2O。
+H2O。
不同温度下,平衡时![]() 的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
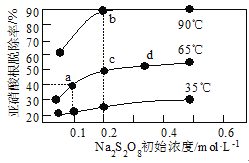
①a、b、c、d四点平衡常数K由大到小的顺序为__,原因是__。
②若a点(0.1,40%)时,![]() 的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
(4)利用新型材料光催化脱除NO法如图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为___。
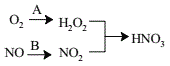
【答案】4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH=-2069.9kJmol-1 HNO3(或NO
5N2(g)+6H2O(l) ΔH=-2069.9kJmol-1 HNO3(或NO![]() ) 温度升高,化学反应速率加快,有利于NO充分反应 温度升高,气体溶解度下降;(或温度升高,ClO-水解增强,HClO发生分解等) Kb>Ka=Kc=Kd a、c、d三点在同一温度下,K值相同;b点温度升高,NO
) 温度升高,化学反应速率加快,有利于NO充分反应 温度升高,气体溶解度下降;(或温度升高,ClO-水解增强,HClO发生分解等) Kb>Ka=Kc=Kd a、c、d三点在同一温度下,K值相同;b点温度升高,NO![]() 的脱除率上升,说明平衡向正向移动,K值增大
的脱除率上升,说明平衡向正向移动,K值增大 ![]() O2+2e-+2H+=H2O2
O2+2e-+2H+=H2O2
【解析】
利用盖斯定律,将已知热化学方程式调整化学计量数进行相加减,便可得到待求热化学反应方程式;Ca(ClO)2与吸收的NO的物质的量之比为3∶4,利用得失电子守恒,便可求出含N产物的存在形式。温度升高,NO的脱除率提高,应由温度升高引起;温度继续升高,NO脱除率反而降低,则必存在副反应,且温度升高有利于副反应的发生。化学平衡常数受温度变化的影响,温度相同时,平衡常数不变;升高温度,平衡正向移动,则K值增大。求平衡常数时,可由已知数据,建立三段式,代入公式便可求出K值。设计原电池时,正极O2→H2O2,则电极反应式为O2得电子产物与H+反应生成H2O2。
(1)①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
③H2O(g)![]() H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1
将①-②×5+③×6得:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH=-2069.9kJmol-1。答案为:4NH3(g)+6NO(g)
5N2(g)+6H2O(l) ΔH=-2069.9kJmol-1。答案为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH=-2069.9kJmol-1;
5N2(g)+6H2O(l) ΔH=-2069.9kJmol-1;
(2) ①发生反应时,Ca(ClO)2中的Cl由+1价降为-1价,则NO失电子后所得产物中N的价态为![]() =5,从而得出脱除后NO转化为HNO3(或
=5,从而得出脱除后NO转化为HNO3(或![]() )。答案为:HNO3(或
)。答案为:HNO3(或![]() );
);
②图中,40~60℃时,随温度的升高,NO脱除率上升,显然温度升高有利于反应的进行,可能的原因为温度升高,化学反应速率加快,有利于NO充分反应;60~80℃时,温度升高,NO脱除率下降,则应为反应物浓度的下降等,所以可能的原因为温度升高,气体溶解度下降;(或温度升高,ClO-水解增强,HClO发生分解等)。答案为:温度升高,化学反应速率加快,有利于NO充分反应;温度升高,气体溶解度下降;(或温度升高,ClO-水解增强,HClO发生分解等);
(3)①a、c、d三点温度相同,平衡常数相等,b点时温度高,亚硝酸根脱除率大,则表明温度升高平衡正向移动,K值增大,则平衡常数K由大到小的顺序为Kb>Ka=Kc=Kd,原因是a、c、d三点在同一温度下,K值相同;b点温度升高,![]() 的脱除率上升,说明平衡向正向移动,K值增大。答案为:Kb>Ka=Kc=Kd;a、c、d三点在同一温度下,K值相同;b点温度升高,
的脱除率上升,说明平衡向正向移动,K值增大。答案为:Kb>Ka=Kc=Kd;a、c、d三点在同一温度下,K值相同;b点温度升高,![]() 的脱除率上升,说明平衡向正向移动,K值增大;
的脱除率上升,说明平衡向正向移动,K值增大;
②pH=13,65℃时Kw=1.0×10-13,则c(OH-)=1mol/L,利用题给数据,可建立如下三段式:

65℃时,第二步反应的平衡常数K=![]() =
=![]() 。答案为:
。答案为:![]() ;
;
(4)某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极为过程A中O2得电子的产物与H+作用生成H2O2,反应方程式为O2+2e-+2H+=H2O2。答案为:O2+2e-+2H+=H2O2。


科目:高中化学 来源: 题型:
【题目】室温下,某二元碱![]() 水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
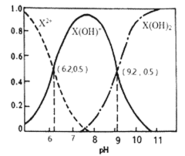
A.![]() 的数量级为
的数量级为![]()
B.![]() 水溶液显碱性
水溶液显碱性
C.等物质的量的![]() 和
和![]() 混合溶液中
混合溶液中![]()
D.在![]() 水溶液中,
水溶液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3水溶液呈弱碱性,并可用作农业化肥,现进行下列研究:现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:
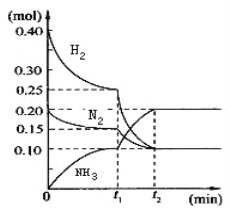
(1)若t1=10min,则0至t1时间内H2的反应速率为_________;
(2)下列几种情形中可以证明合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)已达平衡状态的是_____。
2NH3(g)已达平衡状态的是_____。
①单位时间内生成nmolN2的同时生成2nmolNH3;
②1个N≡N键断裂的同时,有6个N—H键形成;
③1个N≡N键断裂的同时,有3个H—H键形成;
④混合气体的压强不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_____(填字母)
a.加入了催化剂 b.降低了反应的温度 c.缩小容器体积增大压强
(4)t2时刻后反应达平衡,N2总共的转化率为______。
(5)在t1时刻对应的反应条件下,该反应的平衡常数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点气体的平均相对分子质量:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点的反应速率:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molH2(g)与1molI2(g)反应生成HI(g)释放出8.7kJ热量,有关数据如图所示:
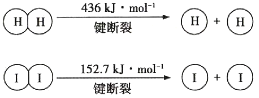
下列说法不正确的是( )
A.H2和I2的总能量低于HI的能量
B.破坏1molH—I键需要的能量是298.7kJ
C.1molHI(g)完全分解生成H2(g)和I2(g)时吸收4.35kJ热量
D.H2(g)中的H—H键比HI(g)中的H—I键牢固
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示裝置制备氯气并进行性质实验(必要时可加热,省略夹持装置)
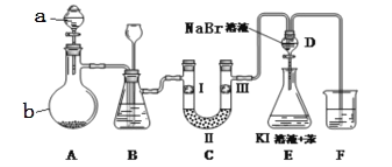
(1)仪器a的名称是:_______;装置B中长颈漏斗的作用是:_______。蒸馏烧瓶b中发生反应的化学方程式为________。
(2)洗气装置B试剂是饱和食盐水,其作用是______,分液漏斗D中发生反应的化学方程式为________。
(3)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式_______。
(4)设计实验比较氯、溴的氧化性强弱。操作和现象和结论为:取适量溴化钠溶液和苯混合于试管中,通入_______,振荡静置,_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com